【メディシノバ】第26回ALS/MND国際シンポジウムにおけるALS(筋萎縮性側索硬化症)を適応とするMN-166の臨床治験中間解析に関するポジティブな結果発表のお知らせ

2015年12 月13 日 米国 ラ・ホイヤ発 - メディシノバ(MediciNova, Inc.)(米国カリフォルニア州 ラ・ホイヤ、代表取締役社長兼CEO:岩城裕一)は、2015年12月11日から13日までフロリダ州オーランドで開催されている、第26回ALS/MND(筋萎縮性側策硬化症/運動神経疾患)国際シンポジウムにおいて、現在実施中のALSを適応とするMN-166のフェーズ2臨床治験に関する中間解析の結果が、治験主任責任医師であるカロライナ・ヘルスケアシステムの神経科学研究所、神経筋/ALS・MDAセンター所長のベンジャミン・リックス・ブルックス博士により発表されましたのでお知らせいたします。中間解析発表の要点は、治験に参加している最初の36名(そのうち33名が二重盲検治験の6ヶ月を完了)におけるデータです。
発表内容の要点は、下記のとおりです。
ベースライン(治験開始前)と6ヶ月後の比較において治験参加群(プラセボ群を含む)は、
過去に報告されているALS試験のデータと比較して、
1) ALS障害レベルを判定するALSFRS-R(改訂版ALS機能評価スケール)の悪化率軽減を認めた
2)肺機能検査におけるSVC (Slow Vital Capacity:肺活量)の悪化率(1.5%/月)は緩やかであった
自施設におけるコントロールデータと比較して、
3)治験参加中に、NIV(Non-Invasive Ventilator:非侵襲的換気補助器)が必要になる割合が低かった(p=0.07)
ことが報告されました。さらに今回の中間解析では安全性、認容性に問題がなかったことも併せて報告されました。
本臨床治験について
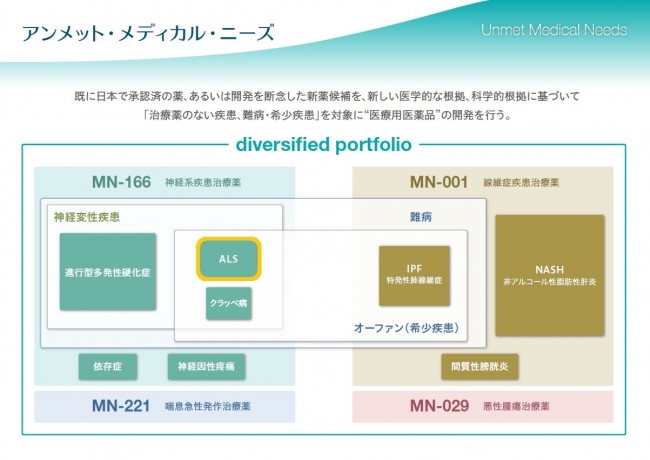
当社は現在、カロライナ・ヘルスケアシステムの神経科学研究所、神経筋/ALS・MDAセンター所長のベンジャミン・リックス・ブルックス博士とともに、初期及び進行ALS患者を対象とするMN-166の治験を行っております。本治験は、6ヶ月間のプラセボ対照、無作為二重盲検に続き、オープンレベル(非盲検) 6ヶ月の合計12ヶ月の治験です。本治験はMN-166の安全性、認容性及び治療効果を評価しますが、治療効果の評価には改訂版ALS機能評価スケール(ALS患者の包括的な重症度指標)、呼吸機能、筋力などの評価項目を含みます。呼吸機器のサポートを受けないALS患者60名及びNIV(非侵襲的換気補助器)のサポートを受けているALS患者60名の、合計120名の患者登録を予定しています。
ALS(筋萎縮性側索硬化症)とは
またの名をルー・ゲーリック病(著名な大リーグ野球選手が罹患したことから)と呼ばれるこの疾病は、脳及び脊椎の神経細胞にダメージを及ぼす進行性の神経変性疾患です。このダメージにより特定の筋肉への指令が届かなくなり、筋肉が萎縮し弱まっていきます。その結果、随意運動が不自由となり、病状末期には全身の運動麻痺に至り人工呼吸器などの補助が必要になります。診断されてからの生存期間は通常2-5年と言われています。 米国ALS協会によると、現在米国には概そ30,000人のALS患者がおり、さらに毎年約5,600人が新たに診断されているとのことです。現在承認されている治療薬はリルゾールのみで、その効果は限定的です。
MN-166(イブジラスト)とは
イブジラストは、日本と韓国で、喘息及び脳梗塞発作後の症状の治療薬としてすでに25年以上使用されています。当社はMN-166を、再発寛解型多発性硬化症を適応とする治療薬候補として、キョーリン製薬からライセンス導入しました。その後当社は、進行型多発性硬化症及び神経症状についての知的所有権を取得しました。 MN-166はファースト・イン・クラスの経口摂取可能な小分子化合物で、ホスホジエステラーゼ-4及び-10の阻害剤、マクロファージ遊走阻止因子(MIF)阻害剤で、炎症促進作用のあるサイトカイン、IL-1β、TNF-a、IL-6などを阻害する働きを有しており、また、反炎症性のサイトカインIL-10、神経栄養因子及びグリア細胞株由来神経栄養因子を活性化する働きも認められています。グリア細胞の活性化を減衰し、ある種の神経症状を緩和することがわかっています。前臨床研究および臨床研究において抗神経炎症作用及び神経保護作用を有することが確認されており、これらの作用がMN-166の神経変性疾患(進行型多発性硬化症、ALSなど)、各種依存症、慢性神経因性疼痛などに対する治療効果の根拠と考えられております。

以上
メディシノバについて
メディシノバ(Medicinova, Inc.)は、日本内外の国際的製薬企業との提携により有望な低分子化合物を導入し、様々な疾患領域の新規医薬品の開発を主として米国で行う公開製薬企業です。現在当社は、進行型多発性硬化症、ALS、薬物依存(メタンフェタミン依存、オピオイド依存など)をはじめとする多様な神経系疾患を適応とするMN-166(イブジラスト)及びNASH、肺線維症など線維症疾患を適応とするMN-001(タイペルカスト)に経営資源を集中することを戦略としております。ほかに喘息の急性発作適応のMN-221(ベドラドリン)及び固形がんを適応とするMN-029(デニブリン)も当社のパイプラインの一部です。MN-166についてはさまざまな適応で開発途中ですが、そのほとんどが、治験責任医師または公的、私的機関からの資金援助により行われています。当社はさらに、戦略的提携または共同機関の資金提供を受けるべく交渉を続けております。
弊社詳細につきましてはhttp://www.medicinova.jpをご覧下さい。メディシノバの所在地はアメリカ合衆国カリフォルニア州ラ・ホイヤ、スイート650、エグゼクティブ・スクエア4275(電話 1-858-373-1500)です。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
