BBI608 の第Ⅰ/Ⅱ相臨床試験(用量漸増試験)結果を米国臨床腫瘍学会(ASCO)で発表
大日本住友製薬株式会社(本社:大阪市、社長:多田 正世)は、2013 年6 月3 日(米国時間)、開発中の抗がん剤「BBI608」に関する第Ⅰ/II 相臨床試験のうち用量漸増試験(以下、本試験)の結果が、米国シカゴで開催中の米国臨床腫瘍学会(ASCO : American Society of Clinical Oncology)の2013 年年次総会において発表されましたので、お知らせします。
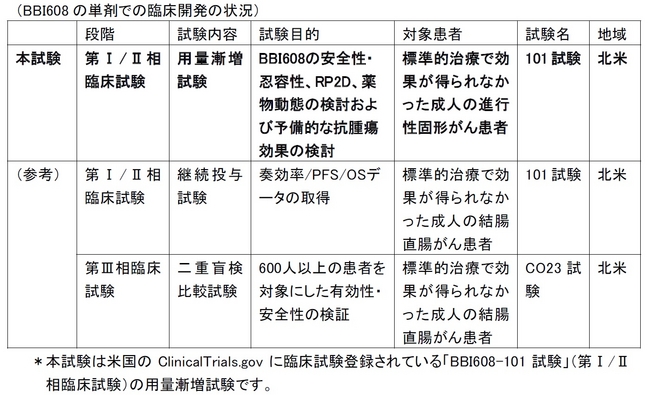
1.本試験の位置づけ
本試験は、BBI608 の安全性・忍容性、第II 相臨床試験の推奨用量(RP2D)、薬物動態の検討および種々のがんに対する予備的な抗腫瘍効果の検討を目的として、2009 年3 月に北米で開始されました。本試験の目的を達成した後、BBI608 の投与量を推奨用量に固定して、結腸直腸がん患者さんを対象にした継続投与試験を実施し、2013 年1 月から、第Ⅲ相臨床試験(目標症例数:650 例)を実施しています。
*BBI608 の単剤での臨床開発の状況については、ご参考の最後に記載しております。
2.本試験の概要
本試験は、標準的治療で効果が得られなかった結腸直腸がん、頭頸部がん、胃がん、卵巣がん、メラノーマ、乳がんなど成人進行性がん患者さん41 人に対して、BBI608 を1 日1-3 回、経口投与することにより実施されました。4 週間投与を1 サイクルとして、病状の進行や、受け入れがたい毒性、その他の中止基準に達するまで投与サイクルが繰り返されました。患者さんを14 のコホート(集団)に分け、それぞれ1 日当たり、20mg から2,000mg までの14 段階で投与されました。
3.本試験の結果
BBI608 の副作用は総じて穏やかであり、最も多く見られた副作用は、グレード1~2 の下痢、吐き気、食欲不振、疲労であり、グレード3 は4 件(下痢および疲労)であり、グレード4 はありませんでした。MTD(最大耐用量)は確認されませんでした。また、血液毒性は認められませんでした。BBI608 の第I/Ⅱ相臨床試験(継続投与試験)の推奨用量を1 日2 回(1 回あたり500mg 投与)に設定しました。
予備的な抗腫瘍効果の検討に関しては、評価可能な患者さん(26 人)のDCR(病勢コントロール率)は65%(17 人)でした。
また、本試験では18 人の結腸直腸がん患者さんに投与されましたが、評価可能な結腸直腸がん患者さんの DCR は67%で、PFS(無増悪生存期間)の中央値は14 週、OS(全生存期間)の中央値は47 週でした。なお、核内β-カテニンまたは高リン酸化Stat3 のバイオマーカーがポジティブな患者さんのOS の中央値は、それぞれ53 週、54 週でした。
当社は、BBI608 の開発成功を最優先課題として注力し、がん幹細胞への効果を持つ世界初のがん治療剤として、2015 年度に北米での発売、2016 年度に日本での発売を目指し、1 日も早く、がん患者の治療に貢献できることを期待しています。
なお、今回の発表演題および発表要旨(概要)につきましては、2013 年5 月9 日および5 月16日に開示しています。
(ご参考:用語解説)
忍容性
薬物によって生じたと判断した有害作用(=副作用)が、被験者にとってどれだけ耐え得るかの程度を示したもの
副作用のグレード:
副作用の重篤度で評価するゼロ~5 までのグレードがあり、5 は「死亡」である。重症度によってグレードが以下のように定義されている。
グレード0:正常。
グレード1:無症状または軽症の症状がある。治療を要さない。
グレード2:中等症であり、最小限/局所的な治療を要する。
グレード3:重症または医学的に重大であるが、ただちに生命を脅かすものではない。入院また
は入院期間の延長を要する。
グレード4:生命を脅かす症状。緊急処置を要する。
グレード5:死亡。
MTD(maximum tolerated dose:最大耐用量):
患者さんが許容できる最大の投与量をMTD(最大耐用量)という。
DCR(病勢コントロール率):
病状をコントロールできている患者さんの割合。RECIST 評価(腫瘍の縮小を判定する方法)におけるCR(complete response:完全奏効)+PR(partial response:部分奏効)+SD(stable disease:安定)の比率となる。
・完全奏効(CR) がんの消失が4 週間続いた状態
・部分奏効(PR) がんの大きさが30%以上縮小し、それが4 週間続いた状態
・安定(SD) PR とPD の間の状態
・進行(PD) がんの大きさが20%以上増加
PFS(progression free survival:無増悪生存期間):
病気が進行することなく生存する期間。
OS(overall survival:全生存期間):
全てを含めて生存する期間。なお、生存期間を評価するときは平均値ではなく中央値で示されることが多い。
β-カテニン:
細胞接着や細胞融合に関する機能や、核内で転写因子と結合して遺伝子の転写を活性化する機能をもつタンパク質。
Stat3:
遺伝子の転写に関与するタンパク質。Stat3 は多くの固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっている。
バイオマーカー:
体内に存在している生体分子のうち、治療や薬効の評価指標などになるもの。
(ご参考:BBI608 について)
BBI608 は、米国子会社Boston Biomedical, Inc.(BBI 社)が創製し、開発中のファースト・イン・クラスの経口の抗がん剤であり、非臨床試験において、Stat3 経路、Nanog 経路およびβ-カテニン経路を抑制することが示されています。
BBI608 は、がん幹細胞(幹細胞様性質を有するがん細胞)の自己複製を阻害し、がん細胞に加え、がん幹細胞に対して細胞死を誘導する新しいメカニズムの低分子化合物です。がん幹細胞およびがん細胞の両方に作用するために、がん治療の課題である治療抵抗性、再発あるいは転移に対する効果が期待されます。
現在、下記の臨床試験を実施中です。
・結腸直腸がん(単剤):第Ⅲ相臨床試験実施中(開発地域:米国・カナダ)
・結腸直腸がん(併用):第Ⅱ相臨床試験実施中(開発地域:米国・カナダ)
・固形がん(パクリタキセルとの併用):第Ⅰ/Ⅱ相臨床試験実施中(開発地域:米国・カナダ)
・固形がん(単剤):第Ⅰ相臨床試験実施中(開発地域:日本)
以上
すべての画像
