病原菌が免疫から逃れて寄生する仕組みを解明
~結核菌のヒト好中球による貪食と殺菌回避の分子メカニズム~
順天堂大学大学院医療看護学研究科・医学研究科環境医学研究所の岩渕和久教授、中山仁志准教授らの研究グループは、結核菌を含む病原性抗酸菌が糖脂質の相互作用を介してヒト好中球内へ取り込まれ、細胞内シグナル伝達経路を遮断することで、細胞内に寄生する仕組みを解明しました。本成果は、多剤耐性結核菌に代表される従来の治療薬が奏功しない感染症への治療に役立つと考えられ、今後の結核への対策に大きく道を開く可能性を示しました。本研究はScience の姉妹紙であるScience Signaling 誌(2016年10月11日号)に発表されました。
【本研究成果のポイント】
・抗酸菌はLAMのマンナンコアとLacCerの脂質ラフトの結合を介してヒト好中球に貪食されることを発見
・好中球に取り込まれた病原性抗酸菌はLacCerの脂質ラフト依存的な細胞内シグナルを遮断する
・貪食・細胞内シグナルを遮断する分子機構をターゲットとした新規病原性抗酸菌感染症治療薬開発へ
【背景】
結核は、全世界で昨年だけで960万人が罹患、150万人が死亡する、死者数が最も多い感染症のひとつです。さらに近年、途上国を中心に多剤耐性結核菌による感染が顕著に増加しており、新たな作用機序に基づく新規結核治療薬の開発が急務とされています。新薬の開発のため細胞内寄生細菌*1である結核菌が宿主の免疫による攻撃からどのように逃れるのか、その分子メカニズムについて多くの研究がなされてきました。
これまでの研究から、結核菌に対する宿主の貪食細胞による殺菌からの回避には糖脂質のマンノース結合型LAM *2(ManLAM)が関与しており、脂質ラフトと呼ばれる細胞膜上のスフィンゴ糖脂質が豊富な部分を介して貪食細胞に貪食された場合は、さらに効率よく殺菌を回避することが分かってきました。また、結核の病態増悪には、結核菌を貪食した好中球が壊死(ネクローシス)することが重要な役割を果たしていることが示されています。
しかしながら、ヒトにおける結核菌や非結核性抗酸菌の殺菌回避メカニズムの詳細は不明でした。そこで、私たち研究グループは病原性抗酸菌によって好中球の貪食・殺菌機構が破綻するメカニズムを明らかにするため、好中球に発現しているラクトシルセラミド(LacCer)*3について調べました。
【内容】
まず、私たち研究グループはヒトの好中球がスフィンゴ糖脂質のラクトシルセラミド(LacCer)を使って病原性抗酸菌を貪食するかの実験を行いました。ヒト好中球の細胞膜上にはLacCerが脂質ラフトを形成しています。抗酸菌とLacCerとの結合実験をした結果、LacCerの脂質ラフトは病原性に依らず抗酸菌のLAMに結合することが分かりました。LAMには、病原性抗酸菌が持つManLAM以外に、ホスファチジルイノシトールキャップ型のLAM(PILAM)やキャップ構造の無いLAMが存在します。また、全ての抗酸菌のLAMには、マンノースがα1,6結合で繋がった糖鎖の所々に、マンノースがα1,2結合したマンナンコアと呼ばれる糖鎖が存在します。そこで、α1,2マンノース側鎖を欠失させた非病原性のM. smegmatis の変異株を作成したところ、好中球は変異株を貪食することが出来ませんでした。さらに、変異株由来のLAMだけがLacCerに結合できず、変異株由来のLAMをコートしたビーズも貪食されませんでした。このことは、全ての抗酸菌はLAMのマンナンコアとLacCerの脂質ラフトの結合を介して好中球に貪食されて、食胞*4が形成されることを示しています(図1)。
【今後の展開】
今回、私たち研究グループが初めて明らかにした、病原性抗酸菌がManLAMを用いてLacCerの脂質ラフトを介して好中球に貪食され、食胞成熟を阻害するメカニズムは、従来の結核治療薬がターゲットとする作用機序とは異なっていました。したがって、今回の成果を応用することで、新たなアプローチからの多剤耐性結核治療薬や非結核性抗酸菌症治療薬の開発に繋がります。今後は、構造活性相関の解明を目指して、LacCerとManLAMとの間の結合の様式を構造学的に解析し、さらに、ManLAMが特異的に抑制するLacCer関連シグナル伝達分子を網羅的に解析することで、ManLAMが標的とするLacCer関連シグナル伝達経路をさらに詳らかにする予定です。このような構造学的・生化学的分子基盤を明らかにすることによって、新規病原性抗酸菌感染症治療薬開発への道が開けるものと確信しています。
【用語解説】
*1:細胞内寄生細菌
結核菌などは細胞内寄生細菌と呼ばれ、様々な方法で細胞内で殺菌されることを阻害し、細胞内で生存・寄生してしまいます。
*2:リポアラビノマンナン(LAM)
抗酸菌に特有の菌体壁糖脂質
*3:ラクトシルセラミド(LacCer)
中性のスフィンゴ糖脂質で、ヒト好中球に発現しており、様々な菌と結合することが古くから知られています。
*4:食胞
細菌は好中球やマクロファージなどの自然免疫を担当する貪食細胞へ取り込まれると細菌を含む小胞を形成します。これを食胞又はファゴゾームと呼びます。
*5:Hck
食胞にリソソームが融合するために必須の顆粒膜に存在する情報伝達分子
*6:リソソーム
好中球などの細胞内には様々なタイプの顆粒が存在しています。その中でも殺菌酵素を多く含む顆粒をリソソームと呼びます。食胞にリソソームが融合することで、菌は酵素によって分解されて、殺菌されます。
【原著論文】
雑誌名: Science Signaling
タイトル:
Lipoarabinomannan binding to lactosylceramide in lipid rafts is essential for the phagocytosis of mycobacteria by human neutrophils
著者:
Hitoshi Nakayama, Hidetake Kurihara, Yasu S. Morita, Taroh Kinoshita, Alessandro Prinetti, Sandro Sonnino, Laura Mauri, Hideoki Ogawa, Noriko Yokoyama, Kenji Takamori, and Kazuhisa Iwabuchi
リンク先: http://stke.sciencemag.org/ に掲載
doi: 10.1126/scisignal.aaf1585
研究助成先:
本研究は文部科学省私立大学戦略的研究基盤形成事業、文部科学省特定領域研究「感染の成立と宿主応答の分子基盤」、科学研究費若手研究(B)(課題番号 25860831, 15K19592)、公益財団法人 水谷糖質科学振興財団、公益財団法人 内藤記念科学振興財団の支援を受け実施されました。
共同研究機関:
本研究は順天堂大学医学部解剖学・生体構造科学講座、大阪大学微生物病研究所、マサチューセッツ大学アマースト校、ミラノ大学との共同研究として実施しました。
・抗酸菌はLAMのマンナンコアとLacCerの脂質ラフトの結合を介してヒト好中球に貪食されることを発見
・好中球に取り込まれた病原性抗酸菌はLacCerの脂質ラフト依存的な細胞内シグナルを遮断する
・貪食・細胞内シグナルを遮断する分子機構をターゲットとした新規病原性抗酸菌感染症治療薬開発へ
【背景】
結核は、全世界で昨年だけで960万人が罹患、150万人が死亡する、死者数が最も多い感染症のひとつです。さらに近年、途上国を中心に多剤耐性結核菌による感染が顕著に増加しており、新たな作用機序に基づく新規結核治療薬の開発が急務とされています。新薬の開発のため細胞内寄生細菌*1である結核菌が宿主の免疫による攻撃からどのように逃れるのか、その分子メカニズムについて多くの研究がなされてきました。
これまでの研究から、結核菌に対する宿主の貪食細胞による殺菌からの回避には糖脂質のマンノース結合型LAM *2(ManLAM)が関与しており、脂質ラフトと呼ばれる細胞膜上のスフィンゴ糖脂質が豊富な部分を介して貪食細胞に貪食された場合は、さらに効率よく殺菌を回避することが分かってきました。また、結核の病態増悪には、結核菌を貪食した好中球が壊死(ネクローシス)することが重要な役割を果たしていることが示されています。
しかしながら、ヒトにおける結核菌や非結核性抗酸菌の殺菌回避メカニズムの詳細は不明でした。そこで、私たち研究グループは病原性抗酸菌によって好中球の貪食・殺菌機構が破綻するメカニズムを明らかにするため、好中球に発現しているラクトシルセラミド(LacCer)*3について調べました。
【内容】
まず、私たち研究グループはヒトの好中球がスフィンゴ糖脂質のラクトシルセラミド(LacCer)を使って病原性抗酸菌を貪食するかの実験を行いました。ヒト好中球の細胞膜上にはLacCerが脂質ラフトを形成しています。抗酸菌とLacCerとの結合実験をした結果、LacCerの脂質ラフトは病原性に依らず抗酸菌のLAMに結合することが分かりました。LAMには、病原性抗酸菌が持つManLAM以外に、ホスファチジルイノシトールキャップ型のLAM(PILAM)やキャップ構造の無いLAMが存在します。また、全ての抗酸菌のLAMには、マンノースがα1,6結合で繋がった糖鎖の所々に、マンノースがα1,2結合したマンナンコアと呼ばれる糖鎖が存在します。そこで、α1,2マンノース側鎖を欠失させた非病原性のM. smegmatis の変異株を作成したところ、好中球は変異株を貪食することが出来ませんでした。さらに、変異株由来のLAMだけがLacCerに結合できず、変異株由来のLAMをコートしたビーズも貪食されませんでした。このことは、全ての抗酸菌はLAMのマンナンコアとLacCerの脂質ラフトの結合を介して好中球に貪食されて、食胞*4が形成されることを示しています(図1)。
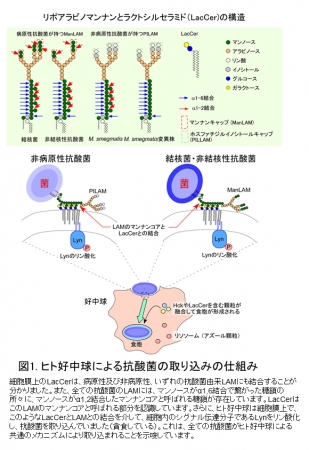 図1:ヒト好中球による抗酸菌の取り込みの仕組み
図1:ヒト好中球による抗酸菌の取り込みの仕組み
次に、PILAMをコートしたビーズを好中球に貪食させると、LacCerの脂質ラフトにはHck*5と呼ばれる食胞にリソソーム*6が融合するために欠かせない細胞内シグナル伝達分子が会合して活性化され、食胞に菌を分解する酵素を含むリソソームが融合しました。一方で、ManLAMをコートしたビーズでは、HckがLacCerの脂質ラフトに会合しませんでした。また、食胞とリソソームの融合も起こらなくなりました(図2)。このことは、結核菌などの病原性抗酸菌はManLAMのマンナンキャップ部分を使ってLacCerの脂質ラフトがHcKと会合することを阻害し、リソソームの食胞への融合を回避することを示しています。以上の結果から、ヒト好中球はLacCerとLAMのマンナンコアとの結合を介して抗酸菌を貪食すること、および、食胞に取り込まれた病原性抗酸菌はManLAMのマンナンキャップを使ってLacCerの脂質ラフトの食胞膜上での形成を阻害することで、殺菌を回避することを明らかにしました。
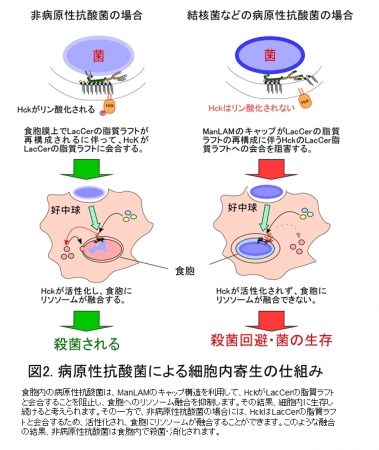 図2:病原性抗酸菌による細胞内寄生の仕組み
図2:病原性抗酸菌による細胞内寄生の仕組み
【今後の展開】
今回、私たち研究グループが初めて明らかにした、病原性抗酸菌がManLAMを用いてLacCerの脂質ラフトを介して好中球に貪食され、食胞成熟を阻害するメカニズムは、従来の結核治療薬がターゲットとする作用機序とは異なっていました。したがって、今回の成果を応用することで、新たなアプローチからの多剤耐性結核治療薬や非結核性抗酸菌症治療薬の開発に繋がります。今後は、構造活性相関の解明を目指して、LacCerとManLAMとの間の結合の様式を構造学的に解析し、さらに、ManLAMが特異的に抑制するLacCer関連シグナル伝達分子を網羅的に解析することで、ManLAMが標的とするLacCer関連シグナル伝達経路をさらに詳らかにする予定です。このような構造学的・生化学的分子基盤を明らかにすることによって、新規病原性抗酸菌感染症治療薬開発への道が開けるものと確信しています。
【用語解説】
*1:細胞内寄生細菌
結核菌などは細胞内寄生細菌と呼ばれ、様々な方法で細胞内で殺菌されることを阻害し、細胞内で生存・寄生してしまいます。
*2:リポアラビノマンナン(LAM)
抗酸菌に特有の菌体壁糖脂質
*3:ラクトシルセラミド(LacCer)
中性のスフィンゴ糖脂質で、ヒト好中球に発現しており、様々な菌と結合することが古くから知られています。
*4:食胞
細菌は好中球やマクロファージなどの自然免疫を担当する貪食細胞へ取り込まれると細菌を含む小胞を形成します。これを食胞又はファゴゾームと呼びます。
*5:Hck
食胞にリソソームが融合するために必須の顆粒膜に存在する情報伝達分子
*6:リソソーム
好中球などの細胞内には様々なタイプの顆粒が存在しています。その中でも殺菌酵素を多く含む顆粒をリソソームと呼びます。食胞にリソソームが融合することで、菌は酵素によって分解されて、殺菌されます。
【原著論文】
雑誌名: Science Signaling
タイトル:
Lipoarabinomannan binding to lactosylceramide in lipid rafts is essential for the phagocytosis of mycobacteria by human neutrophils
著者:
Hitoshi Nakayama, Hidetake Kurihara, Yasu S. Morita, Taroh Kinoshita, Alessandro Prinetti, Sandro Sonnino, Laura Mauri, Hideoki Ogawa, Noriko Yokoyama, Kenji Takamori, and Kazuhisa Iwabuchi
リンク先: http://stke.sciencemag.org/ に掲載
doi: 10.1126/scisignal.aaf1585
研究助成先:
本研究は文部科学省私立大学戦略的研究基盤形成事業、文部科学省特定領域研究「感染の成立と宿主応答の分子基盤」、科学研究費若手研究(B)(課題番号 25860831, 15K19592)、公益財団法人 水谷糖質科学振興財団、公益財団法人 内藤記念科学振興財団の支援を受け実施されました。
共同研究機関:
本研究は順天堂大学医学部解剖学・生体構造科学講座、大阪大学微生物病研究所、マサチューセッツ大学アマースト校、ミラノ大学との共同研究として実施しました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
