κオピオイド受容体バイアスドシグナリングに関与する分子スイッチを同定
―複数の最先端技術を統合し、創薬戦略に資する構造情報を獲得―
【発表のポイント】
-
Cryo-EM SPA(クライオ電子顕微鏡単粒子解析)*1・全反射赤外分光法(ATR-FTIR)*2・薬理学的解析・分子動力学(MD)シミュレーション*3という複数の先端技術を統合し、κオピオイド受容体(KOR) *4のバイアスドシグナリング(選択的シグナル伝達)5の分子実体の詳細を解明
-
2種類の作動薬(ナルフラフィン *6/U-50,488H *7)による受容体活性化の立体構造を可視化し、シグナル分岐の起点となるアミノ酸残基を同定
-
本成果は、副作用を抑えたオピオイド系鎮痛薬など、次世代創薬戦略に向けた重要な分子設計指針を提供
明治大学理工学研究科 光武亜代理准教授、学校法人関西医科大学(大阪府枚方市 理事長・山下敏夫、学長・木梨達雄)医学部医化学講座 清水(小林)拓也教授、寿野良二准教授、名古屋工業大学生命・応用化学類 片山耕大准教授、神取秀樹特別教授、京都大学大学院薬学研究科・東北大学大学院薬学研究科井上飛鳥教授(京都大学/東北大学)、筑波大学国際統合睡眠医科学研究機構 斉藤毅准教授、大阪大学蛋白質研究所 加藤貴之教授らの共同研究グループは、ヒトκオピオイド受容体のバイアスドシグナリング機構を従来より詳細に解析し、新たにシグナル選択性に関与するアミノ酸残基を同定しました。
なお、本研究をまとめた論文が『Nature Communications(インパクトファクター:15.7)』に10月28日(火)10時付(ロンドン標準時。日本時間同日19時)で掲載されました。
<書誌情報>

|
掲載紙 |
『Nature Communications』 |
|
論文タイトル |
Structural and Dynamic Insights into the Biased Signaling Mechanism of the Human Kappa Opioid Receptor |
|
筆者 |
Chiyo Suno-Ikeda†, Ryo Nishikawa†, Riko Suzuki†, Shun Yokoi, Seiya Iwata, Tomoyo Takai, Takaya Ogura, Mika Hirose, Akihisa Tokuda, Risako Katamoto, Akitoshi Inoue, Eri Asai, Ryoji Kise, Yukihiko Sugita, Takayuki Kato, Hiroshi Nagase, Ayori Mitsutake, Tsuyoshi Saitoh, Kota Katayama, Asuka Inoue, Hideki Kandori, Takuya Kobayashi*, Ryoji Suno* †These authors contributed equally * Corresponding Authors |
<本研究の背景>
Gタンパク質共役型受容体(GPCR)*8は、細胞外の刺激を多様な細胞応答へと変換する生命現象の中核を担う膜タンパク質群であり、医薬品標的としても極めて重要です。GPCRは三量体Gタンパク質*9、β-アレスチン*10、Gタンパク質受容体キナーゼ(GRK)*11など複数の細胞内因子と結合し、それぞれ異なるシグナル経路を活性化します。特定の細胞内因子との選択的な結合・活性化によって生じる偏ったシグナル伝達(バイアスドシグナリング)は、副作用発現の一因であると同時に、副作用の少ない新薬設計の鍵として国際的に注目されています。オピオイド受容体作動薬は強力な鎮痛効果を示しますが、「呼吸抑制」「依存形成」「鎮静」「薬物嫌悪」などの重篤な副作用が社会問題となっています。中でもκ(カッパ)オピオイド受容体(KOR)作動薬は、かゆみや慢性痛の治療に有望ですが、副作用のため臨床応用が制限されてきました。2009年、長瀬博博士らにより薬物嫌悪を軽減したKOR作動性の難治性そう痒症治療薬ナルフラフィン(レミッチ®/ノピコール®)が開発され、KORが再び創薬ターゲットとして注目されました。しかし、鎮静作用などの副作用は完全には抑制できず、その原因はKORによるβ-アレスチンシグナル伝達にあると考えられています。近年、望ましいGタンパク質経路を選択的に活性化し、副作用につながるβ-アレスチン経路を抑制する薬剤設計が「バイアスドシグナリング」として注目され、創薬イノベーションの鍵とされています。Tao Cheらは、KORのナルフラフィン結合型結晶構造と分子動力学シミュレーションから、バイアスドシグナリングに関与するアミノ酸残基や動的構造を提唱しました(Che et al., 2023)。しかし、実験的な静的・動的構造解析を組み合わせて、シグナル分岐の分子機構を特定した例は限られていました。
<本研究の概要>
本研究では、κオピオイド受容体(KOR)のバイアスドシグナリング機構を分子レベルで詳細に理解することを目的とし、構造生物学・分光学・薬理学・計算科学を融合した多角的解析を行いました。具体的には、クライオ電子顕微鏡単粒子解析(Cryo-EM SPA)により2種類の作動薬(ナルフラフィン、U-50,488H)結合型KOR–Giタンパク質複合体の高解像度構造を決定し、結合様式の違いを明らかにしました。さらに、全反射赤外分光法(ATR-FTIR)を用いて薬剤結合に伴う動的構造変化を検出し、薬理学的解析によりシグナル選択性に関与する4つのアミノ酸残基(K227、Y312、C286、H291)を同定しました。加えて、分子動力学(MD)シミュレーションを用いて、これらの残基がシグナル分岐に果たす役割を原子レベルで検証しました。これらの統合的解析により、KORにおける「良い作用」と「副作用」の分かれ道を構造的・機能的に可視化することに成功しました。
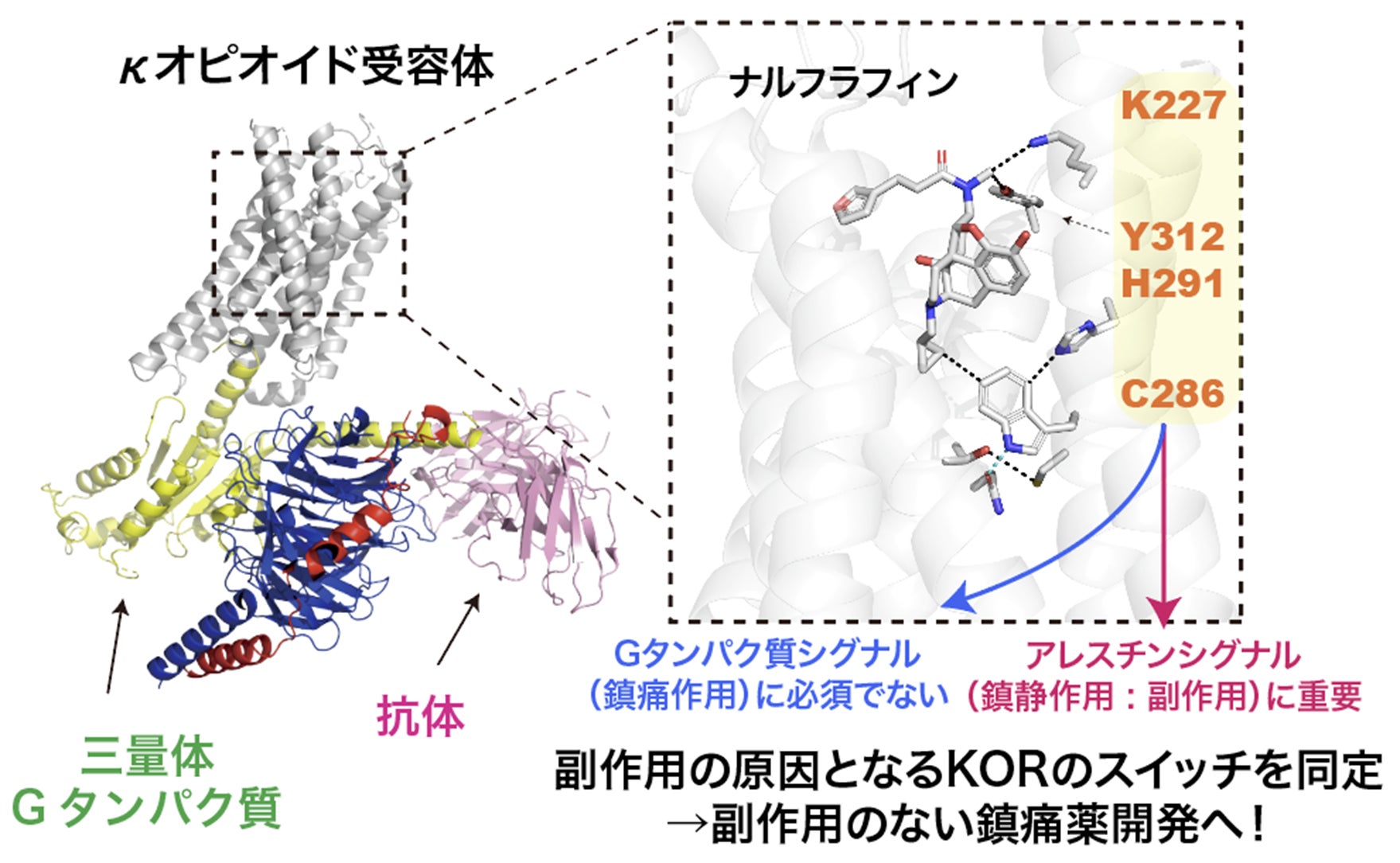
<本研究の成果>
今回、関西医科大学 医学部医化学講座 清水(小林)拓也教授、寿野良二准教授らの研究グループは、Cryo-EM SPAによってKORを活性化する2つの作動薬(ナルフラフィン、U-50,488H)がそれぞれ結合したKOR-Giタンパク質複合体構造をそれぞれ2.76, 2.90Å分解能で決定することに成功しました(図1)。まず、得られた構造情報をもとに作動薬結合様式を明らかにし、京都大学/東北大学 井上飛鳥教授の研究グループと共同で変異体シグナルアッセイ(NanoBiT assay)を実施しました。その結果、シグナル選択性に関わる2つのアミノ酸(K227, Y312)を同定することに成功しました。K227は両作動薬と結合様式は異なるものの、アラニン変異体ではGタンパク質シグナル活性はほぼ変わらず、β-アレスチンリクルート活性のみが大きく減少しました。Y312でも両作動薬と結合距離が異なりますが、アラニン/フェニルアラニン変異体ではGタンパク質シグナル活性の最大活性は変わらず、β-アレスチンリクルート活性のみが大きく減少しました。これらの結果から、この2つのアミノ酸はβ-アレスチンリクルート活性に重要であることが明らかになりました(図2)。
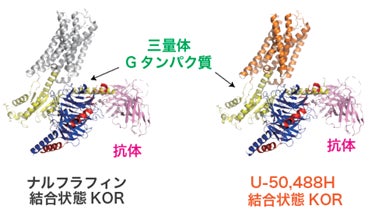
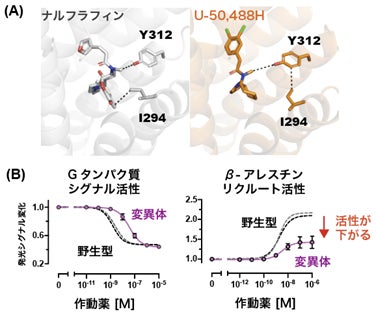
次に、名古屋工業大学 神取秀樹特別教授、片山耕大准教授らの研究グループと共同で、独自に開発した全反射赤外分光法(ATR-FTIR)と二液交換系を組み合わせた測定手法を用い、2つの作動薬結合に伴う構造変化を赤外差スペクトルとして高精度に抽出し、捉えることに成功しました。Cryo-EM SPAで得られたKOR活性型構造は、Gタンパク質結合状態の静的な構造情報であるのに対し、ATR-FTIRではKORに作動薬が結合する前後の動的な構造変化を検出できます。その結果、システイン残基およびヒスチジン残基に対応するシグナルが変化し、これらのアミノ酸が作動薬依存的な構造変化に関与していることが示唆されました。KOR内のシステイン残基、ヒスチジン残基について変異体のシグナルアッセイを行ったところ、C286とH291のアラニン変異体はGタンパク質シグナル活性の最大活性は変わらず、β-アレスチンリクルート活性のみが大きく減少しました。これらの結果から、この2つのアミノ酸もβ-アレスチンリクルート活性に重要であることが明らかになりました。不活性型構造(PDB ID: 4DJH)と活性型構造を比較するとC286とT321の側鎖間距離が変化しており、この第5・ 第6膜貫通ヘリックス間の相互作用がβ-アレスチンリクルート活性に必須であることが示されました(図3)。また、H291の側鎖はGPCRの活性化に重要なトグルスイッチと呼ばれるトリプトファン残基W287の側鎖と相互作用し、その向きを制御していると考えられました。つまり、H291のアラニン変異体はW287の側鎖と相互作用が失われ、β-アレスチンリクルート活性に適さない配向をとっていると推定されました。
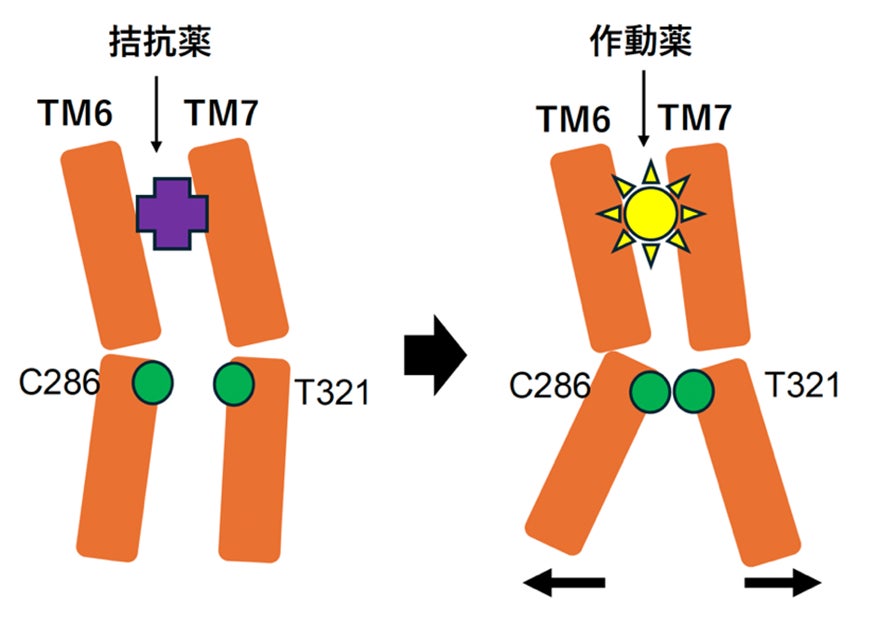
最後に、上述の技術で同定したシグナル分岐点の4つのアミノ酸が、変異体ではなぜβ-アレスチンリクルート活性を失うのかについて明治大学 光武亜代理准教授と筑波大学 横井駿博士が解析を行いました。着目したのは、既報のアンジオテンシン受容体AT1におけるバイアスドシグナリングの分子動力学シミュレーション研究で報告された、GPCRの活性化に重要なDRYモチーフ内アルギニン残基の側鎖配向です。既報では、このアルギニン残基の側鎖がGタンパク質シグナル活性を示すときは細胞外側に、β-アレスチンシグナル活性を示すときは細胞内側に配向すると報告されています。KORの野生型および各変異体についてこの配向を解析した結果、変異体ではアルギニン側鎖が細胞内側に向く構造状態の割合が低下していました。つまり、これらの4つの変異体は、β-アレスチンシグナルを活性化する状態になりにくい構造状態を形成することが明らかになりました。
<今後の展望>
今回同定された4つのアミノ酸残基は、鎮静などKOR作動薬の副作用に直結するβ-アレスチン経路の活性化に必須であり、これらを標的とした薬剤設計は、副作用を抑えつつ有効性を保つ新規鎮痛薬やかゆみ止め薬の開発を大きく前進させると期待されます。さらに、本研究で確立した「Cryo-EMによる静的構造解析」と「ATR-FTIRによる動的構造解析」、および「薬理実験・MDシミュレーションを組み合わせた統合解析手法」は、KORに限らず、他のGPCRファミリーや難治性疾患の創薬標的にも適用可能です。最終的には、疼痛・かゆみ・精神疾患・がんなど、多様な疾患に対する副作用の少ない革新的治療薬の開発に貢献することが期待されます。
<研究助成>
本研究は、JSPS KAKENHI 学術変革領域「マルチスケールな生理作用の因数分解基盤構築」(領域代表:斉藤毅)(JP21H05111, JP21H05112, JP21H05113, JP21H05115)、JSPS KAKENHI (JP19H03428, JP24K02231, JP21H04791, JP21H05113, JPJSBP120218801, JP20H03230, JP23KJ1997)、JSPS 特別推進研究(JP21H04969)、AMED CREST (JP21gm0910007)、AMED先端的バイオ創薬等基盤技術開発事業創薬基盤推進事業(JP21am0401020)、AMED創薬基盤推進事業(JP20ak0101103)、AMEDムーンショット(JP21zf0127005、JPMJMS2023)、MEXT leader program、the Young Runners in Strategy of Transborder Advanced Researches (TRiSTAR) program、日本応用酵素協会」、JST FOREST(JPMJFR215T)、JST SPRING、JST Mirai Program(JPMJMI22H5)、世界トップレベル研究拠点プログラム(WPI)、「武田研究振興財団」、「内藤記念科学振興財団」、「小柳財団」、BINDSの支援により実施されました。
<用語解説>
*1 クライオ電子顕微鏡単粒子解析
極低温環境でタンパク質試料に電子線を照射し、様々な角度からの投影像から3次元構造を計算して電子マップを得る手法。2017年にノーベル化学賞を受賞した。
*2 全反射赤外分光法(ATR-FTIR)
赤外光を試料表面に全反射させ、界面に生じるエバネッセント波を利用して分子振動を検出する分光法。化学結合の振動状態変化を鋭敏に捉えられるため、タンパク質の二次構造や局所的環境変化を解析できる。
*3 分子動力学シミュレーション
コンピュータ上で原子レベルでの分子の動きを解析する方法。実験では得ることが難しいタンパク質の動的な構造変化の情報を得ることができる。
*4 κオピオイド受容体(KOR)
オピオイド受容体の一種。作動薬は鎮痛薬として開発が期待されているが、鎮静、薬物嫌悪の副作用が問題となっている。
*5 バイアスドシグナリング
同じ受容体に対して異なるリガンドがそれぞれ異なるシグナル伝達経路を選択的に活性化する現象。望ましい作用(例:鎮痛)と望ましくない作用(例:鎮静)が“選り分けられる”リガンドであれば、副作用の軽減が期待される。
*6 ナルフラフィン
KOR作動薬。薬物嫌悪の副作用の分離に成功し、難治性そう痒症の治療薬(販売名レミッチ®/ノピコール®)として使用実績がある。
*7 U-50,488H
研究で広く使われるKOR作動薬。鎮静、薬物嫌悪の副作用を示すことが報告されている。
*8 Gタンパク質共役型受容体(G protein-coupled receptor : GPCR)
7回膜貫通ヘリックス構造をもつ膜タンパク質。光、匂い物質、ホルモン、神経伝達物質などの外からの刺激を細胞内に伝える受容体。多くの医薬品がこの受容体を標的にしている。
*9 三量体Gタンパク質
α,β,γの3つのサブユニットからなる細胞内シグナル伝達調節因子。活性化したGPCRと結合すると、乖離して活性化し、情報を細胞内に伝える働きを持つ。
*10 β-アレスチン
GPCR の細胞内シグナル伝達調節因子の一種で、リン酸化を受けた GPCR と結合してGPCR の内在化を誘導、シグナルの脱感作を制御する。また、β-アレスチンを起点とした多様なシグナル伝達も誘導する。
*11 Gタンパク質受容体キナーゼ(GRK)
GPCRと相互作用してリン酸化する細胞内タンパク質で、主にGPCRの脱感作を制御する。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
