副作用原因タンパク質 hERG チャネルと薬剤の複合体構造を明らかにすることに成功−重篤な副作用の回避にもクライオ電子顕微鏡解析が役立つ−
hERG チャネルを阻害する化合物は心毒性を引き起こすリスクが高いため、hERG チャネルの働きを阻害しない化合物の創製が必要です。今回の結果は、重篤な副作用の原因となるタンパク質と薬剤の複合体構造をクライオ電子顕微鏡で明らかにできることを示したもので、医薬品開発においてクライオ電子顕微鏡解析を用いた単粒子解析が薬剤による副作用の予測と、それを回避するための基盤技術となることが期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)の一環として産官学連携のもとで遂行されたプロジェクトです。本研究成果は、2021 年1月15 日(金)0 時 30 分(日本時間)付で米国科学誌『Structure』(Cell Press)にオンラインで掲載されました。
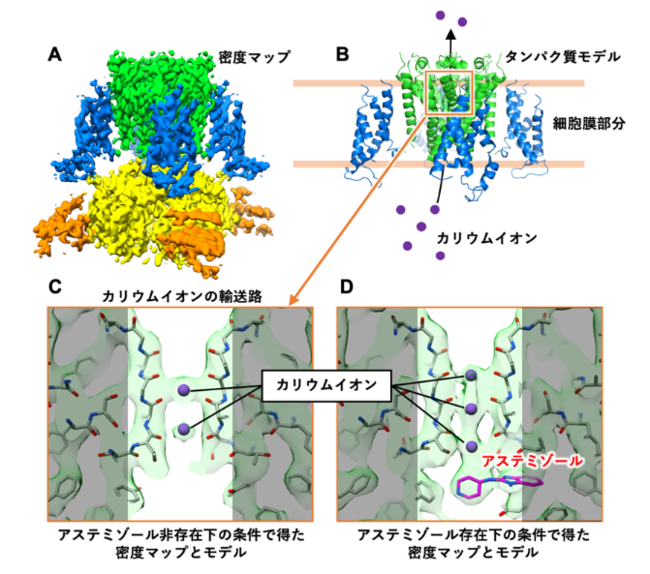 図1 今回の研究で明らかになったhERGチャネルの密度マップおよび hERGとアステミゾールの複合体構造のタンパク質モデル
図1 今回の研究で明らかになったhERGチャネルの密度マップおよび hERGとアステミゾールの複合体構造のタンパク質モデル
- 研究の背景と経緯
開発した薬剤が示す副作用は、創薬の現場において重要な問題となります。心臓への副作用により発症する致死性不整脈は、hERGチャネルの働きを阻害することが主な原因であることが明らかとなっています。1990年代にhERGチャネル阻害によって引き起こされる致死性不整脈が原因で市場から撤退した化合物が複数あったことから、近年では医薬品の承認申請に際して、すべての医薬品候補化合物に対してhERGチャネルへの影響を実験で検証することが要求されています。
hERGチャネル阻害の回避は、創薬プロセスにおける初期段階から様々な手法を用いて試みられていますが、それらが必ずしも上手くいくわけではなく、医薬品候補化合物の合理的設計のためには化合物とhERGチャネルとの複合体の立体構造情報が必要です。2003年のノーベル化学賞受賞者であるRoderick MacKinnonらの研究チームによって、2017年にhERGチャネルの立体構造が報告されましたが、未だに阻害活性を示す化合物とhERGチャネルとの複合体構造は得られておらず、化合物がhERGチャネルにどのように結合し阻害活性を示すのかについては未解明の部分が多く残されていました。そこで、研究チームは、hERGチャネルを研究対象とし、阻害剤であるアステミゾールとの結合様式や阻害メカニズムの解明を目的に、クライオ電子顕微鏡を用いた単粒子解析に取り組みました。
- 研究成果
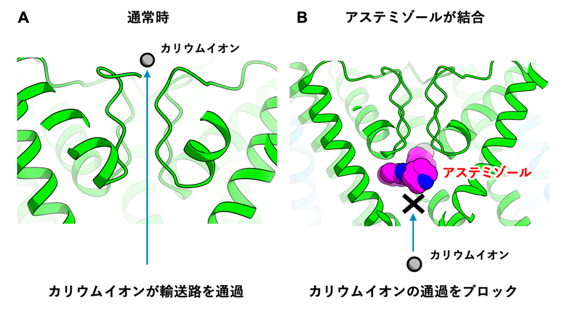 図2 hERGチャネルにアステミゾールが結合する様子
図2 hERGチャネルにアステミゾールが結合する様子
KEK 物質構造科学研究所 構造生物学研究センターのクライオ電子顕微鏡を用い、hERGチャネルの発現・精製条件やクライオ電子顕微鏡での撮影条件を詳細に検討することにより、アステミゾールの存在下と非存在下の両条件においてhERGチャネルの密度マップを取得し(分解能としてhERGチャネル単体3.9 Å, hERG-アステミゾール複合体3.5 Å)、そこからタンパク質モデルを構築することに成功しました(図1A, B)。そしてアステミゾールは、カリウムイオンの輸送路近傍に結合していることが分かりました(図1C, D)。
このことから、アステミゾールはhERGチャネルのカリウムイオンの入口を塞ぐように結合し、カリウムイオンの通過を立体障害的に防ぐことにより阻害活性を示すことが示唆されました(図2)。その他のhERG阻害剤に関しても、アステミゾールと類似の結合様式でhERGチャネルに結合し、カリウムイオンの輸送を阻害することが予測されます。
- 今後の展望
今回、産官学が協力し、多くの製薬会社が共通して取り扱っている標的タンパク質に対し、クライオ電子顕微鏡を用いることで比較的短期間のうちに複合体構造を決定することができました。AMEDの事業であるBINDSの枠組みを利用することで、個社では取り組みにくかった課題に効率的に取り組めることを示すとともに、クライオ電子顕微鏡解析の創薬基盤技術としての有用性を示していると考えられます。
- 研究支援
本研究は、Axcelead Drug Discovery Partners株式会社、アステラス製薬株式会社、小野薬品工業株式会社、第一三共RDノバーレ株式会社、武田薬品工業株式会社、AMED BINDS(JP20am0101083、JP20am0101071)などの支援を受けて実施されました。
- 論文情報
掲載誌
Structure、2021年1月15日オンライン掲載
論文タイトル
Cryo-EM structure of K+-bound hERG channel complexed with the blocker astemizole
著者
Tatsuki Asai, Naruhiko Adachi, Toshio Moriya, Hideyuki Oki, Takamitsu Maru, Masato Kawasaki, Kano Suzuki, Sisi Chen, Ryohei Ishii, Kazuko Yonemori, Shigeru Igaki, Satoshi Yasuda, Satoshi Ogasawara, Toshiya Senda & Takeshi Murata
- 用語解説
(注1)hERG(human ether-à-go-go related gene)チャネル
細胞内外の各種イオン濃度の勾配によって生じる膜電位に応答して活性化されるカリウムチャネルであり、神経や心臓の細胞機能において重要な役割を持つタンパク質である。特に心臓での機能はよく知られている。他のカリウムチャネルと類似のアミノ酸配列、立体構造を保有しているが、非常に特徴的な性質を持っている。それが心臓の拍動における活動電位の迅速な終結(再分極)に大きく寄与しており、hERGチャネルの阻害が致死性不整脈の主な原因となっていることが広く知られている。
(注2)アステミゾール
アレルギー性鼻炎の症状を緩和する薬剤として、1988年に販売承認を受け上市されていた医薬品であるが、その後複数の研究で報告されたアステミゾールと因果関係のある有害事象や、米国食品医薬品局が発表した副作用の報告に関するレポート等を受けて、1999年に市場から撤退した。アステミゾールが毒性を示す原因として、高い親和性でhERGチャネルに結合し、その機能を阻害してしまうことが明らかとなっている。
(注3)クライオ電子顕微鏡単粒子解析
クライオ電子顕微鏡は、サンプルを極低温下に保ち電子線写真を撮影することのできる透過型顕微鏡である。タンパク質の粒を多数撮影し、デ-タ処理により三次元の詳細な構造情報を得る解析法を単粒子解析と呼ぶ。サンプル調製法、単粒子解析の方法論、電子検出器の発展など、技術開発が着々と進められてきた結果、2010年代に入って以降、クライオ電子顕微鏡を用いた単粒子解析によって近原子分解能のタンパク質構造が数多く報告されるようになった。2017年のノーベル化学賞は「クライオ電子顕微鏡の開発」に貢献した研究者3氏に授与された。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
