老化による遺伝子変異が免疫異常の引き金に〜独自に開発したアルゴリズムの活用にも期待〜
千葉大学グローバルプロミネント研究基幹の小野寺淳准教授、千葉大学の中山俊憲学長らの研究チームは、米国のラホヤ免疫研究所(LJI)とカリフォルニア大学サンディエゴ校(UCSD)のAnjana Rao教授との共同研究で、TET遺伝子(注1)の欠損が免疫細胞に及ぼす影響について研究しました。その結果、TET欠損はゲノムの化学構造に異常をきたし、炎症を増悪させる効果があることが分かりました。
これまでのヒトにおける研究で、老化に伴うTET2遺伝子変異と疾患の関連が報告されていることから、本研究の結果により、TET酵素の機能を補完することで老化が引き起こす炎症性疾患の治療に結びつくことが期待されます。
本研究成果は、2021年6月22日に、学術誌 Genome Biologyで公開されました。
これまでのヒトにおける研究で、老化に伴うTET2遺伝子変異と疾患の関連が報告されていることから、本研究の結果により、TET酵素の機能を補完することで老化が引き起こす炎症性疾患の治療に結びつくことが期待されます。
本研究成果は、2021年6月22日に、学術誌 Genome Biologyで公開されました。
- 研究の背景
一方、ヒトでは老化により様々な遺伝子変異が蓄積していきます。このうちTET2遺伝子の変異は、白血病の原因(発症は年間数%程度)になることが知られていますが、血管の炎症とも関連し、心筋梗塞や狭心症などのリスクが1.4倍以上高くなることが分かっています。
そこで研究チームは、マウス実験モデルを用いて、TET遺伝子と老化による免疫異常の関係の一端を明らかにするため、実験を行いました。
- 研究の成果
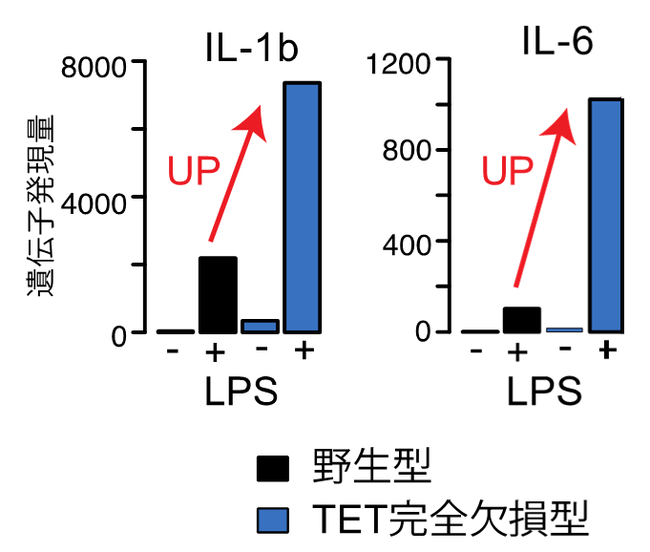 図1.TET完全欠損による炎症性サイトカイン遺伝子の高発現
図1.TET完全欠損による炎症性サイトカイン遺伝子の高発現
上記の知見や技術を基に、TET遺伝子が欠損し細胞の老化が進んだ「TET完全欠損マウス」をモデルとしてTET遺伝子の異常と免疫の関係を調査しました。リポ多糖(LPS:注2)で刺激した結果、TET完全欠損マウス由来のマクロファージ(注3)において、炎症を引き起こすIL-1bやIL-6などの炎症性サイトカイン(注4)遺伝子の発現が顕著に上昇することが明らかとなりました(図1)。また、DNAの網羅的な解析技術を用いて、TET酵素と関わりが深い特定の目印のゲノム上の位置を、マクロファージにおいて特定しました。これにより、TET遺伝子の生体内での働きについて、これまで考えられていたものと異なる機能を併せ持つ可能性が示唆されました。
- 研究成果詳説
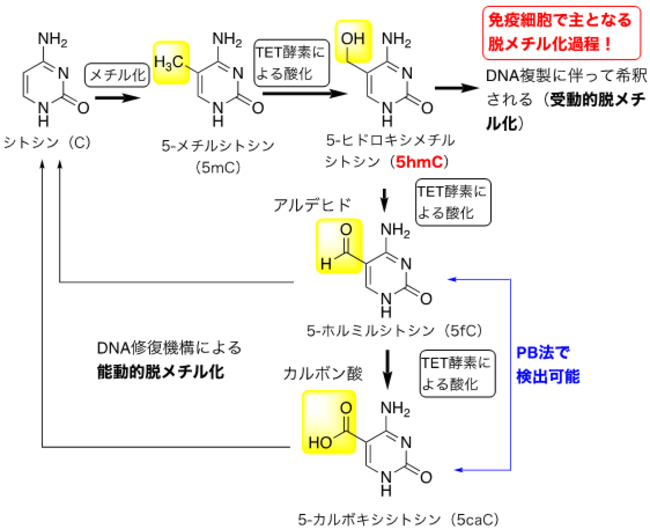 図2.DNAシトシンメチル化と脱メチル化
図2.DNAシトシンメチル化と脱メチル化
TET遺伝子から作られるTET酵素は、シトシンのメチル基を酸化することで、間接的に脱メチル化を誘導します(図2)。TET酵素によって誘導される脱メチル化には、酸化されたメチル化シトシン(5hmC)がDNA複製に伴って希釈される受動的なものと、酸化がさらに進んだメチル化DNAが修復されることで起こる能動的なものの二種類があります。
本研究では、免疫細胞で起こる脱メチル化の大部分は前者の受動的な機構に依存することが分かりました。ただ、後者の能動的な機構も寄与は小さいながらも確かに働いていることが分かりました。これらの結果から、受動的および能動的脱メチル化は対等なものでなく、細胞の種類によって厳密に使い分けられることが明らかとなり、基礎生物学上重要な知見が得られました。
(2) 遺伝子解析技術上の成果〜免疫細胞の異常をシンプルな化学反応で検出
シトシンのメチル基の酸化が進むと、アルデヒドやカルボン酸と呼ばれる化学構造ができます(図2)。これらの化学構造を検出する最新の技術が最近発表されました(Pyridine Borane: PB法)。この技術を開発した英国Oxford大学チームとの共同研究により、免疫細胞では世界で初めて上記の化学構造を検出することに成功しました。この検出が可能になったことで、採取の難しい少数細胞検体での遺伝子解析が期待されます。
また、次世代シークエンス(注5)解析技術開発に関する進展もありました。研究チームは、ヘルパーT細胞(注6)をモデルとして、独自の解析アルゴリズムを開発することで、「近くにあるDNAメチル化同士がどのように影響を及ぼし合うか」を数値化することに成功しました。その結果メチル化同士の距離が近いほど、相互作用が大きく、連動して脱メチル化されていくことが分かりました。今後はより長いDNAを解析することで、距離の遠いメチル化同士の相互作用を解析し、複雑な遺伝子制御機構解明への応用が期待できます。
(3) 免疫学上の成果〜TET遺伝子と免疫異常の関係の一端が明らかに
ヒトではTET2遺伝子変異と疾患との関連が報告されていますが、研究チームは、TET2だけでなく、TET1とTET3遺伝子も欠損させた「TET完全欠損マウス」を使って実験を行いました。TET2のみの欠損では疾患発症に数ヶ月程かかるのですが、本モデルでは、細胞レベルでの老化を非常に短期間で誘導できます。
実験の結果、TET完全欠損マウス由来のマクロファージにおいて、IL-1bやIL-6などの炎症性サイトカイン遺伝子の発現が顕著に上昇することが明らかとなりました(図1)。このことから、これらのサイトカインで誘導される血管炎症の抑制にはTETの酵素活性が重要であることが示唆されました。
また、次世代シークエンスを使った解析で、TET欠損のない正常マクロファージにおける、TET酵素により酸化されたメチル化シトシン(5hmC)のゲノム上の位置を網羅的に特定しました。特筆すべきは、炎症性サイトカインの遺伝子の近くに、5hmCが蓄積することが明らかになったことです。TET酵素の本来の働きは5hmCを介して遺伝子発現をONにすることです。ところがこの実験結果は、TET酵素が5hmC集積を介して炎症性サイトカイン遺伝子発現をOFFにする機能を併せ持つ可能性を示唆し、本研究における新たな発見となりました。5hmCがどのように炎症と関わっているのかについて今後さらに研究を進めることで、血管炎症抑制の鍵となるメカニズムの解明が期待されます。
- 今後の展望
また、本研究で用いた化学反応による検出方法(PB法)やDNAメチル化の解析アルゴリズムは、将来的にがん細胞の診断や分類、免疫細胞の異常の検出など様々な応用が期待でき、医学の発展に大いに寄与することが見込まれています。
- 用語解説
注2)LPS:リポ多糖と呼ばれる糖と脂質が結合した構造を持つ物質。ある種の細菌の外膜を構成する成分で、マクロファージやB細胞(下記参照)はLPSを認識する受容体を介して細菌の侵入を感知し、炎症反応を誘導する。
注3)マクロファージ:白血球の1種で単核食細胞系に分類される。病原体や死んだ細胞を捕食することで、生体防御に寄与する。炎症性マクロファージと呼ばれる集団は、サイトカインを産生して、血管の動脈硬化を誘導することが知られている。
注4)サイトカイン:細胞が分泌する液性因子であり、細胞間の情報伝達を仲介する。中でもインターロイキン(IL)と呼ばれる一連のグループは主に免疫系の細胞から分泌され、免疫系が正常に働くために重要であるが、IL-1bやIL-6は炎症性サイトカインと呼ばれ、分泌が過剰になると病的な炎症が誘導される。
注5)次世代シークエンス:DNAの塩基配列を素早く大量に読むことのできる技術のことで、新型コロナウイルスの変異株の解析にも応用されている。サンディエゴは関連するバイオテック企業の集積地で、世界で圧倒的なシェアを占める。
注6)ヘルパーT細胞:白血球の1種でB細胞とともにリンパ球に分類される。T細胞はさらにキラーT細胞とヘルパーT細胞に分類され、前者は癌細胞やウイルスに感染した細胞などを攻撃し排除する。後者はサイトカインと呼ばれる液性因子を分泌し、B細胞やキラーT細胞の働きを助ける役割を担う。
- 研究プロジェクトについて
・科学研究費助成事業「T細胞における受動的及び能動的DNA脱メチル化機構の解明」(課題番号18K07164, 研究代表者 小野寺 淳)
・科学研究費助成事業「病原性免疫記憶の成立機構の解明 -難治性炎症疾患の病態の理解へ-」(課題番号JP19H05650, 研究代表者 中山 俊憲)
- 論文情報
著者:Roles of TET and TDG in DNA demethylation in proliferating and non-proliferating immune cells
雑誌名:Genome Biology, 22(1):186.
DOI:https://doi.org/10.1186/s13059-021-02384-1
- 参考URL
LJIウェブサイト:
https://www.lji.org/news-events/news/post/hard-working-enzyme-keeps-immune-cells-in-line/
Eurekalert:
https://www.eurekalert.org/pub_releases/2021-06/ljif-hek062521.php
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
