アビオメッド、日本において「IMPELLA 補助循環用ポンプカテーテル」による症例が1,000件に達したことを発表
画期的な心臓補助テクノロジーのリーディングカンパニーであるアビオメッド・インク(本社:米国マサチューセッツ州ダンバース、CEO マイケル・R・ミノーグ、以下「アビオメッド」)は、日本においてIMPELLA(インペラ)ポンプカテーテルによる治療の症例数が1,000件に達したことを発表しました。「IMPELLA 補助循環用ポンプカテーテル」(IMPELLA 2.5®、およびIMPELLA 5.0®)は、心原性ショック等の薬物療法抵抗性の急性心不全を適応として承認された、日本で唯一の経皮的一時的心室補助デバイスです。
日本で初めての治療は、急性心不全の患者さんに対して、2017 年10月に大阪大学大学院医学系研究科外科学講座心臓血管外科学教授である澤 芳樹先生の指導の下、大阪大学医学部附属病院においてIMPELLA 5.0®を使用して実施されました。初症例以降、10月3日時点で100の施設においてIMPELLAによる治療の実施が可能であり、補助人工心臓治療関連学会協議会 インペラ部会により138施設が認定を受けています。
また、日本において2019年3月末までにIMPELLAが使用された580名の患者さんにおける治療の効果(アウトカム)は、速報値ではありますが、IMPELLAによって治療された心原性ショックを伴う急性心筋梗塞と心筋炎の患者さんのIMPELLA抜去時の生存率において、従来の治療法と比較して顕著な改善を示していることがわかりました。
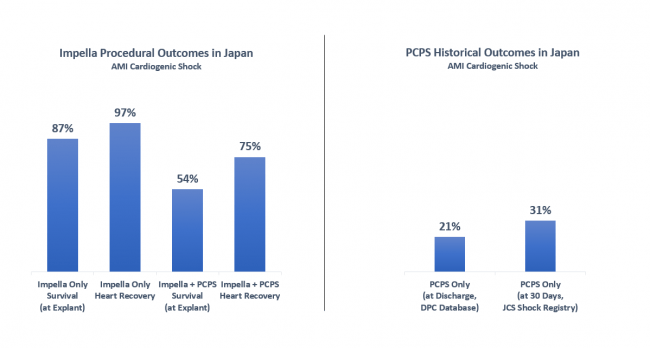
【心原性ショックを伴う急性心筋梗塞の症例】
- IMPELLAのみで治療した症例(n=109)
IMPELLA抜去時生存率 87% 1) 心機能回復率1) 2) 97%
- IMPELLAと経皮的心肺補助装置(PCPS)を併用して治療した症例(n=89)
IMPELLA抜去時生存率 54% 1) 心機能回復率1) 2) 75%
- 過去に報告された従来治療法の経皮的心肺補助装置(PCPS)で治療された症例
生存率 21% 3) ~ 31% 4)
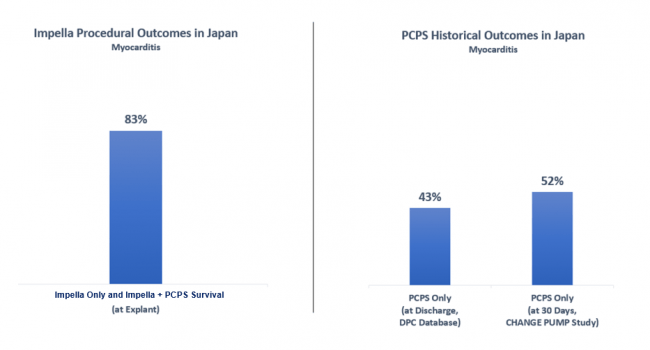
- IMPELLAのみ、およびIMPELLAと経皮的心肺補助装置(PCPS)を併用して治療した症例(n=62)
IMPELLA抜去時生存率 83% 1)
- 過去に報告された従来治療法の経皮的心肺補助装置(PCPS)のみで治療された症例
生存率 43% 3) ~ 52% 5)
大阪大学大学院医学系研究科 教授 澤 芳樹先生は、 「2017年10月に初症例が実施されて以降、IMPELLAの治療を受ける患者さんの数は着実に増加しています。日本では、これまでになかった新たな心臓治療の選択肢として多くの心臓専門医の皆さんがIMPELLAの有効性を理解し、積極的に施設での採用に取り組んでいます。その結果、初症例から約2年で、IMPELLAによる治療は全国100施設で実施されるまでになり、素晴らしい臨床成績を上げています6) 。今後、IMPELLAがより多くの施設で使われることにより、急性心不全を起こした患者さんの救命に貢献するとともに、より多くの患者さんの心機能の回復に寄与できることを期待しています。」と述べています。
日本アビオメッド株式会社 代表取締役 西村栄三は、「初症例が実施されてから約2年の間、ベストプラクティスを取り入れたプロトコルに基づく厳格なトレーニングにより、安全で適切な方法でIMPELLAの臨床実績を積み重ねてきました。データで示されたように、IMPELLAは、患者さんの生存率と心機能回復率を高め、循環補助を「治療」へと変える可能性を持つ新しい選択肢です。この革新的なテクノロジーを、日本の医療関係者の皆様のご尽力によって、これまで安全に効果的にご使用いただき、日本で心疾患に苦しむ患者さんにお届けできていることに、心より感謝申し上げます。IMPELLAによる治療が、“心臓を回復させる(Heart Recovery)”という領域を創り出し、一人でも多くの患者さんが自らの心機能を回復させ、いつもの生活に戻れることを実現するため、全社を挙げてIMPELLAの普及に引き続き貢献してまいります。」と述べています。
1)補助人工心臓治療関連学会協議会 インペラ部会 (2019年3月時点 日本アビオメッド集計速報値)
2)抜去時生存値のうち、IABP、PCPS、VAD等のその他の補助循環への移行がなかった割合
3)Aso, Critical Care. 2016. 20:80 DPC Database
4)Ueki, PE-767. JCS2016 Poster Session the JCS Shock Registry
5)Sawamura, Circ J 2018; 82:699-707 at 30 days
6) O’Neill, AHJ 2018; 202:33-38
IMPELLA補助循環用ポンプカテーテルの日本国内での適応と使用方法
米国および欧州における「IMPELLA」について(参考として米国および欧州の現状を説明するものです。日本の承認とは異なります。)
IMPELLAは欧州では2004年、米国では2008年から承認され、臨床で使用されて以来、2018年秋には累計使用症例が10万例を超えて、循環補助デバイスとして広く普及しています。
IMPELLA 2.5®およびIMPELLA CP®は、米国食品医薬品局(FDA)より市販前承認(PMA)を受けた心内留置型ポンプで、閉塞した冠動脈を再開通させるため、ステント治療やバルーン血管形成などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全の患者の治療としても承認されています。
IMPELLA2.5®, IMPELLA CP®, IMPELLA CP with SmartAssist®, IMPELLA 5.0®、IMPELLA LD® およびIMPELLA 5.5 TM with SmartAssist®は、心原性ショック状態にある急性心不全を起こした患者さんの治療デバイスとして米国食品医薬品局(FDA)より承認を受けています。心臓の自然な回復を可能にする独自の機能を有しているため、患者さんは自分の心機能を有したまま帰宅することができます。
IMPELLA RP® は、左心室補助人工心臓の埋込、心筋梗塞、心臓移植、開心術後に続発する右心不全または代償不全の治療デバイスとして米国食品医薬品局(FDA)に承認を受けています。
欧州では、IMPELLA 2.5®、IMPELLA CP®, IMPELLA CP® with SmartAssist®は心原性ショックを伴う急性心筋梗塞、開心術後ショック、低心拍出量症候群など左心機能が低下した患者さんや高リスクPCIを受ける患者さんの最長5日間の治療を対象としてCEマークが付与されています。IMPELLA 5.0®およびIMPELLA LD®は、心原性ショックを伴う急性心筋梗塞、開心術後ショック、低心拍出量症候群、または心筋症などの患者さんの最長10日間の治療を対象としてCEマークが付与されています。Impella 5.5™は、急性心筋梗塞または心原性ショックを伴う心筋症の患者さんの最長30日間の治療を対象としてCEマークが付与されています。 IMPELLA RP®は左心室補助人工心臓の埋込、心筋梗塞、心臓移植、開心術または難治性不整脈に続発する右心不全または代償不全の治療を対象としてCEマークが付与されています。
IMPELLAに関する承認済の適応症、使用にあたっての重要な安全性およびリスクの情報は、www.impella.comをご参照ください(英語のみ)。
アビオメッド・インクについて
米国マサチューセッツ州ダンバースに本社を置くアビオメッド・インクは、補助循環デバイスのリーディングカンパニーです。当社の製品は、血行動態を改善し、心臓のポンプ機能を補助することで心筋の負担を軽減し、その回復を目指しています。米国FDAの承認ならびに欧州のCEマーク認証取得を含む詳しい情報については、アビオメッド・インクのウェブサイト(www.abiomed.com) をご参照ください。
アビオメッドのロゴ、ABIOMED、IMPELLA、IMPELLA 2.5®、IMPELLA 5.0®、IMPELLA LD®、IMPELLA CP®、IMPELLA RP®、Impella Connect®、SmartAssist®は、米国および特定諸国でアビオメッド・インクによって商標登録されています。Impella BTR, Impella 5.5, Impella ECPおよび CVAD Studyはアビオメッド・インクによって商標登録出願中です。
将来の見通しに関する情報
本プレスリリースには、アビオメッドの既存製品および新製品の開発、営業活動による企業としての成長、将来的可能性、および行政当局による承認の見込みに関する記述等の将来の見通しに関する記述が含まれます。当社の実績は多くの要因によりこの将来の見通しに関する記述の中で記載の予測とは大きく異なる可能性があり、これらの要因には、開発や試験、関連行政当局による承認に伴う不確定要素、さらには将来的な損失が生じる可能性、複雑な製造工程、高品質に関する要件、限られた供給源への依存、競争、技術的変更、行政規制、訴訟問題、今後の資金需要と追加資金の不確実性に加え、直近に提出されたForm 10-Kの年次報告書とForm 10-Qの四半期報告書を含めた証券取引委員会に提出した当社の報告書に記載されたその他のリスクおよび課題が含まれます。利用者は本プレスリリースの発表日時点に述べられている将来の見通しに関するいかなる記述についても過度に依拠することのないようお願い致します。当社は、本プレスリリースの発行日以降に発生する事象、または予想外の出来事の発生によって、見通りまたは予測など、当社の将来の業績に関する見通しを更新し、または修正する義務を負うものではありません。
本件に関する報道関係者からのお問合せ
日本アビオメッド株式会社
パブリックリレーションズ部 篠原乙記
電話 03-4588-5317
メール pr_japan@abiomed.com
また、日本において2019年3月末までにIMPELLAが使用された580名の患者さんにおける治療の効果(アウトカム)は、速報値ではありますが、IMPELLAによって治療された心原性ショックを伴う急性心筋梗塞と心筋炎の患者さんのIMPELLA抜去時の生存率において、従来の治療法と比較して顕著な改善を示していることがわかりました。
【心原性ショックを伴う急性心筋梗塞の症例】
- IMPELLAのみで治療した症例(n=109)
IMPELLA抜去時生存率 87% 1) 心機能回復率1) 2) 97%
- IMPELLAと経皮的心肺補助装置(PCPS)を併用して治療した症例(n=89)
IMPELLA抜去時生存率 54% 1) 心機能回復率1) 2) 75%
- 過去に報告された従来治療法の経皮的心肺補助装置(PCPS)で治療された症例
生存率 21% 3) ~ 31% 4)
- IMPELLAのみ、およびIMPELLAと経皮的心肺補助装置(PCPS)を併用して治療した症例(n=62)
IMPELLA抜去時生存率 83% 1)
- 過去に報告された従来治療法の経皮的心肺補助装置(PCPS)のみで治療された症例
生存率 43% 3) ~ 52% 5)
大阪大学大学院医学系研究科 教授 澤 芳樹先生は、 「2017年10月に初症例が実施されて以降、IMPELLAの治療を受ける患者さんの数は着実に増加しています。日本では、これまでになかった新たな心臓治療の選択肢として多くの心臓専門医の皆さんがIMPELLAの有効性を理解し、積極的に施設での採用に取り組んでいます。その結果、初症例から約2年で、IMPELLAによる治療は全国100施設で実施されるまでになり、素晴らしい臨床成績を上げています6) 。今後、IMPELLAがより多くの施設で使われることにより、急性心不全を起こした患者さんの救命に貢献するとともに、より多くの患者さんの心機能の回復に寄与できることを期待しています。」と述べています。
日本アビオメッド株式会社 代表取締役 西村栄三は、「初症例が実施されてから約2年の間、ベストプラクティスを取り入れたプロトコルに基づく厳格なトレーニングにより、安全で適切な方法でIMPELLAの臨床実績を積み重ねてきました。データで示されたように、IMPELLAは、患者さんの生存率と心機能回復率を高め、循環補助を「治療」へと変える可能性を持つ新しい選択肢です。この革新的なテクノロジーを、日本の医療関係者の皆様のご尽力によって、これまで安全に効果的にご使用いただき、日本で心疾患に苦しむ患者さんにお届けできていることに、心より感謝申し上げます。IMPELLAによる治療が、“心臓を回復させる(Heart Recovery)”という領域を創り出し、一人でも多くの患者さんが自らの心機能を回復させ、いつもの生活に戻れることを実現するため、全社を挙げてIMPELLAの普及に引き続き貢献してまいります。」と述べています。
1)補助人工心臓治療関連学会協議会 インペラ部会 (2019年3月時点 日本アビオメッド集計速報値)
2)抜去時生存値のうち、IABP、PCPS、VAD等のその他の補助循環への移行がなかった割合
3)Aso, Critical Care. 2016. 20:80 DPC Database
4)Ueki, PE-767. JCS2016 Poster Session the JCS Shock Registry
5)Sawamura, Circ J 2018; 82:699-707 at 30 days
6) O’Neill, AHJ 2018; 202:33-38
IMPELLA補助循環用ポンプカテーテルの日本国内での適応と使用方法
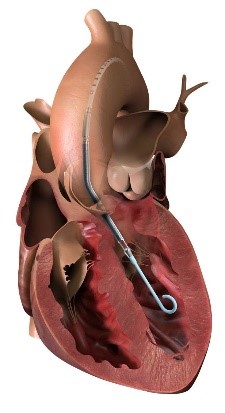 左室に挿入・留置されたIMPELLA 2.5®
左室に挿入・留置されたIMPELLA 2.5®
IMPELLA補助循環用ポンプカテーテル(IMPELLA 2.5®およびIMPELLA 5.0®)は、日本において2016年9月に製造販売承認を取得し、2017年9月に保険収載されました。
日本では、IMPELLAは心原性ショック等による薬物療法抵抗性の急性心不全に対して適応されます。使用方法は、開胸手術をせず、経皮的/経血管的にポンプカテーテルを挿入し、左心室内に挿入・留置したポンプカテーテル先端の吸入部から血液を吸引し、上行大動脈に位置した吐出部から送り出すことにより、順行性の血液体循環を補助します。心機能の回復が迅速に求められる患者さんに対し、このように低侵襲で心筋への負荷を軽減しながら順行性の血流補助を迅速に行うことで、血行動態の改善、心臓の回復を目指すことが可能となります。(イラスト:左室に挿入・留置されたIMPELLA 2.5®)
販売名 IMPELLA 補助循環用ポンプカテーテル
承認番号 22800BZI00032000
販売名 IMPELLA 制御装置
承認番号 22800BZI00031000
米国および欧州における「IMPELLA」について(参考として米国および欧州の現状を説明するものです。日本の承認とは異なります。)
IMPELLAは欧州では2004年、米国では2008年から承認され、臨床で使用されて以来、2018年秋には累計使用症例が10万例を超えて、循環補助デバイスとして広く普及しています。
IMPELLA 2.5®およびIMPELLA CP®は、米国食品医薬品局(FDA)より市販前承認(PMA)を受けた心内留置型ポンプで、閉塞した冠動脈を再開通させるため、ステント治療やバルーン血管形成などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全の患者の治療としても承認されています。
IMPELLA2.5®, IMPELLA CP®, IMPELLA CP with SmartAssist®, IMPELLA 5.0®、IMPELLA LD® およびIMPELLA 5.5 TM with SmartAssist®は、心原性ショック状態にある急性心不全を起こした患者さんの治療デバイスとして米国食品医薬品局(FDA)より承認を受けています。心臓の自然な回復を可能にする独自の機能を有しているため、患者さんは自分の心機能を有したまま帰宅することができます。
IMPELLA RP® は、左心室補助人工心臓の埋込、心筋梗塞、心臓移植、開心術後に続発する右心不全または代償不全の治療デバイスとして米国食品医薬品局(FDA)に承認を受けています。
欧州では、IMPELLA 2.5®、IMPELLA CP®, IMPELLA CP® with SmartAssist®は心原性ショックを伴う急性心筋梗塞、開心術後ショック、低心拍出量症候群など左心機能が低下した患者さんや高リスクPCIを受ける患者さんの最長5日間の治療を対象としてCEマークが付与されています。IMPELLA 5.0®およびIMPELLA LD®は、心原性ショックを伴う急性心筋梗塞、開心術後ショック、低心拍出量症候群、または心筋症などの患者さんの最長10日間の治療を対象としてCEマークが付与されています。Impella 5.5™は、急性心筋梗塞または心原性ショックを伴う心筋症の患者さんの最長30日間の治療を対象としてCEマークが付与されています。 IMPELLA RP®は左心室補助人工心臓の埋込、心筋梗塞、心臓移植、開心術または難治性不整脈に続発する右心不全または代償不全の治療を対象としてCEマークが付与されています。
IMPELLAに関する承認済の適応症、使用にあたっての重要な安全性およびリスクの情報は、www.impella.comをご参照ください(英語のみ)。
アビオメッド・インクについて
米国マサチューセッツ州ダンバースに本社を置くアビオメッド・インクは、補助循環デバイスのリーディングカンパニーです。当社の製品は、血行動態を改善し、心臓のポンプ機能を補助することで心筋の負担を軽減し、その回復を目指しています。米国FDAの承認ならびに欧州のCEマーク認証取得を含む詳しい情報については、アビオメッド・インクのウェブサイト(www.abiomed.com) をご参照ください。
アビオメッドのロゴ、ABIOMED、IMPELLA、IMPELLA 2.5®、IMPELLA 5.0®、IMPELLA LD®、IMPELLA CP®、IMPELLA RP®、Impella Connect®、SmartAssist®は、米国および特定諸国でアビオメッド・インクによって商標登録されています。Impella BTR, Impella 5.5, Impella ECPおよび CVAD Studyはアビオメッド・インクによって商標登録出願中です。
将来の見通しに関する情報
本プレスリリースには、アビオメッドの既存製品および新製品の開発、営業活動による企業としての成長、将来的可能性、および行政当局による承認の見込みに関する記述等の将来の見通しに関する記述が含まれます。当社の実績は多くの要因によりこの将来の見通しに関する記述の中で記載の予測とは大きく異なる可能性があり、これらの要因には、開発や試験、関連行政当局による承認に伴う不確定要素、さらには将来的な損失が生じる可能性、複雑な製造工程、高品質に関する要件、限られた供給源への依存、競争、技術的変更、行政規制、訴訟問題、今後の資金需要と追加資金の不確実性に加え、直近に提出されたForm 10-Kの年次報告書とForm 10-Qの四半期報告書を含めた証券取引委員会に提出した当社の報告書に記載されたその他のリスクおよび課題が含まれます。利用者は本プレスリリースの発表日時点に述べられている将来の見通しに関するいかなる記述についても過度に依拠することのないようお願い致します。当社は、本プレスリリースの発行日以降に発生する事象、または予想外の出来事の発生によって、見通りまたは予測など、当社の将来の業績に関する見通しを更新し、または修正する義務を負うものではありません。
本件に関する報道関係者からのお問合せ
日本アビオメッド株式会社
パブリックリレーションズ部 篠原乙記
電話 03-4588-5317
メール pr_japan@abiomed.com
すべての画像
