「肺がんに対する新たな免疫療法の確立を目指して」医師主導治験でクラウドファンディングに挑戦~昭和大学
肺がん患者さんの長期生存が期待される免疫療法の解明をめざして
<3つのポイント>
◎治療が難しい 肺がんに対する新たな免疫療法の確立を目指す
◎昭和大学初の医師主導治験が始動、全国の11病院と連携
◎クラウドファンディングの活用で資金調達を達成する 5月18日よりスタート!!
◎治療が難しい 肺がんに対する新たな免疫療法の確立を目指す
◎昭和大学初の医師主導治験が始動、全国の11病院と連携
◎クラウドファンディングの活用で資金調達を達成する 5月18日よりスタート!!
➀肺がんはいまだ死亡率が高く治療が難しいがん
肺がんは1998年には胃がんを抜いて死亡率で第1位となり、2018年には約7万4300人が肺がんで亡くなっています。男女別の死亡者数は、男性で約5万2400人(死亡率第1位)、女性で約2万1900人(死亡率第2位)となっています(厚生労働省「2018年人口動態統計」)。
特に肺がんの約8割を占める非小細胞がんは、早期では症状が乏しく、進行してから発見されることが多いこと、従来の抗がん剤治療は、進行を一時的に抑えることができても治すことが難しいことが影響していると考えられます。
➁「免疫チェックポイント阻害剤」での生存率向上と解決すべき課題
新しい免疫療法薬である「免疫チェックポイント阻害剤」の登場などで肺がん患者さんの生存率の向上し、がん免疫療法を受けた進行肺がんの患者さんの中に、治療の効果がカンガルーの尾のように長く続く患者さんがいることがわかってきました。このような特徴を「カンガルーテール現象」と呼んでいます。
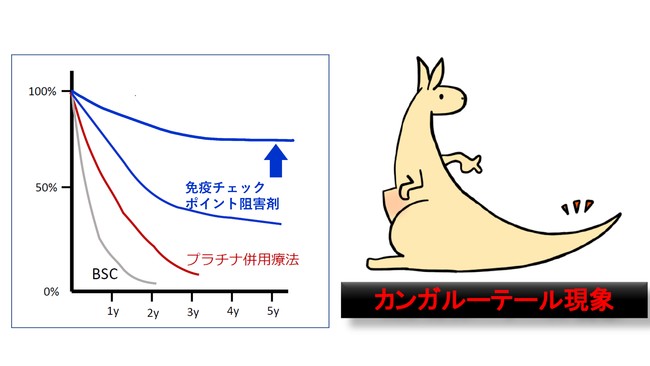
図1. がんが治る治療法の期待とカンガルーテール現象
しかし、どんな患者さんに効果があるのか、どうすれば、より多くの患者さんが、がん免疫療法の効果を得ることができるのか、まだ、解明していないことがたくさんあります。
③2つの抗体薬の併用療法で免疫学的な相乗効果が期待される
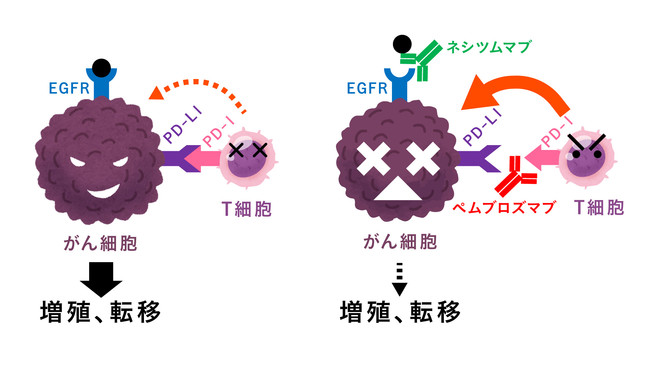
今回、私たちは、これまでにがん薬物療法を受けたことがないPD-L1が高発現の非小細胞肺がんの患者さんを対象に、ネシツムマブというEGFR抗体薬とペムブロリズマブという免疫チェックポイント阻害薬の併用療法の有効性をみる医師主導治験を実施します。
がん免疫療法は、これまでの抗がん剤のようにがん細胞を直接攻撃するのではなく、がん細胞周囲の環境を制御し、患者さん自身の免疫の力でがんを治す治療法です。現在、肺がんの患者さんでは、がん細胞上のPD-L1という免疫チェックポイント分子が強く出ている患者さんで、免疫チェックポイント阻害薬の効果が得やすいと言われていますが、PD-L1が強く出ていても免疫チェックポイント阻害薬の効果がない患者さんがいることもわかっています。
今回、治験薬として用いるネシツムマブは、がん細胞上にあり、がん細胞の増殖のアクセルとなるEGFRという分子を抑える薬剤で、ネシツムマブと免疫チェックポイント阻害薬であるペムブロリズマブを一緒に使用することで、免疫のブレーキを解除し、がんの増殖のアクセルを抑えることで、がん免疫療法の効果を高められるのではと考えています。
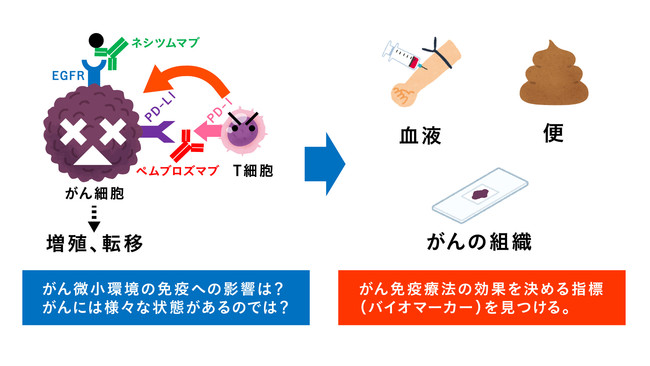
④新たな免疫療法の確立のため様々な検体を用いて免疫学的機能解析を行う
がん免疫療法は、これまでの抗がん剤治療とは、根本的に治療原理が異なる新しい治療法のため、まだ、解明されていないことがたくさんあります。
今回の医師主導治験では、ご同意を頂いた患者さんから血液、便、がんの組織を研究用に提供して頂き、がん免疫療法の効果を決める指標(バイオマーカー)を探求します。
<治験のまとめ>
●主要目的として
PD-L1高発現未治療進行非小細胞肺がんに対するネシツムマブ+ペムブロリズマブ併用療法の有効性を評価する。
●探索的目的として
腫瘍組織検体、血液検体、便検体を用いて、免疫学的機能解析を行い、本療法の有効症例のプロファイルを評価する。
「Mircobiota解析」「免疫担当細胞解析」「腫瘍解析」等
➄協力病院(北から)とともに全国規模の治験体制を構築
昭和大学病院とともに弘前大学医学部附属病院、東北大学病院、福島県立医科大学附属病院、東京都立駒込病院、三井記念病院、東京慈恵会医科大学附属病院、昭和大学江東豊洲病院、NTT東日本関東病院、昭和大学横浜市北部病院、横浜市立市民病院の11病院の専門医と連携した治験実施体制を構築しています。
●医師主導治験とは
治験は企業が医療機関に依頼して行う治験(企業治験)と医師自らが行う治験(医師主導治験)に分類されますが、いずれも、薬事法に基づく臨床試験の実施の基準(GCP:Good Clinical Practice)が適用され、その遵守が求められます。
企業にとって多額の費用負担が難しい分野、たとえば患者数の少ない小児領域や希少疾患や難病、すでに適応外使用が当然となっている医薬品などに関しては、臨床現場の様々な問題の解決や可能性の追求のために医師主導治験は不可欠となっています。
●クラウドファンディングの活用
医師主導治験の最大の問題は人的・経済的な負担が大きいことです。膨大な臨床データを解析し、有効症例にかかわるあらゆる要素を徹底的に検証してその条件などをとらえていくことには多額の予算が必要となるため、本プロジェクトはクラウドファンディングを活用することにいたしました。
クラウドファンディングを呼び掛けることで、実質的に不足している臨床データの解析の予算を確保しつつ、新しい可能性を秘めた肺がんに対する免疫療法のための治験に関心を持っていただきたいという思いです。
昭和大学としては医師主導治験もクラウドファンディングも初めての試みであり、多くの方のご理解とご協力を切にお願いいたします。
●クラウドファンディングへのご参加はこちらでお願いいたします。
『命を救う新たな選択肢を!肺がんに対する免疫療法の治験を利用した研究』
https://readyfor.jp/projects/kangarootail
●昭和大学ホームページ
https://www.showa-u.ac.jp/news/nid00003005.html
<治験の概略>
●目的
主要目的
PD-L1高発現未治療進行非小細胞肺がんに対するネシツムマブ+ペムブロリズマブ併用療法の有効性を評価する。
探索的目的
腫瘍組織検体、血液検体、便検体を用いて、免疫学的機能解析を行い、本療法のバイオマーカー等の探索を行い、有効症例のプロファイルを評価する。
●対象
PD-L1高発現(TPS≧50%)未治療進行非小細胞肺がん
●予定症例数
50例
●実施期間
2020年12月~2024年12月
<実施体制>
- 治験調整委員会
角田卓也 昭和大学病院腫瘍内科 主任教授
小林真一 昭和大学臨床薬理研究所 所長
三邉武彦 昭和大学医学部薬理学講座臨床薬理学部門 准教授
今村知世 昭和大学先端がん治療研究所 准教授
- 治験調整事務局
龍 家圭 昭和大学臨床薬理研究所 講師 昭和大学統括研究推進センター
大熊遼太朗 昭和大学病院腫瘍内科 助教
- 附随研究部分担当
- 吉村 清 昭和大学臨床薬理研究所臨床免疫腫瘍学部門 教授
- 試験統計家・統計解析担当者
- 効果安全性評価委員会
栁谷典子 公益財団法人がん研究会有明病院呼吸器内科 副部長
工藤慶太 国立病院機構大阪南医療センター呼吸器腫瘍内科 医長
- 参加施設(北から)
- 弘前大学医学部附属病院
- 東北大学病院
- 福島県立医科大学附属病院
- 東京都立駒込病院
- 三井記念病院
- 東京慈恵会医科大学附属病院
- 昭和大学江東豊洲病院
- NTT東日本関東病院
- 昭和大学病院
- 昭和大学横浜市北部病院
- 横浜市立市民病院
引用文献
1.Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced NonSmall-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study. J Clin Oncol 2019; 37(28): 2518-27.
2.Reck M, Rodriguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016; 375(19): 1823-33.
3.Mok TSK, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet 2019; 393(10183): 1819-30.
4.Gandhi L, Rodriguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med 2018; 378(22): 2078-92.
5.Paz-Ares L, Luft A, Vicente D, et al. Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer. N Engl J Med 2018; 379(21): 2040-51.
6.Thatcher N, Hirsch FR, Luft AV, et al. Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line therapy in patients with stage IV squamous non-small-cell lung cancer (SQUIRE): an open-label, randomised, controlled phase 3 trial. Lancet Oncol 2015; 16(7): 763-74.
7.Watanabe S, Yoshioka H, Sakai H, et al. Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line treatment for stage IV squamous non-small cell lung cancer: A phase 1b and randomized, open-label, multicenter, phase 2 trial in Japan. Lung Cancer 2019; 129: 55-62.
8.Akbay EA, Koyama S, Carretero J, et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors. Cancer Discov 2013; 3(12): 1355-63.
9.Besse B, Garrido P, Cortot AB, et al. Efficacy and safety of necitumumab and pembrolizumab combination therapy in patients with Stage IV non-small cell lung cancer. Lung Cancer 2020; 142: 63-9.
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像