新型コロナウイルス不顕性感染後、半年間の抗体継続は24.2%。飲酒習慣とARBは抗体継続に影響する可能性あり。
自然感染者が国民の7割を超えると集団免疫が成立する期待があったが、抗体は半年で約2割まで低下。自然感染による集団免疫は期待できない。有効な薬剤が広く早期に使用できない現状では、ワクチン接種が重要。
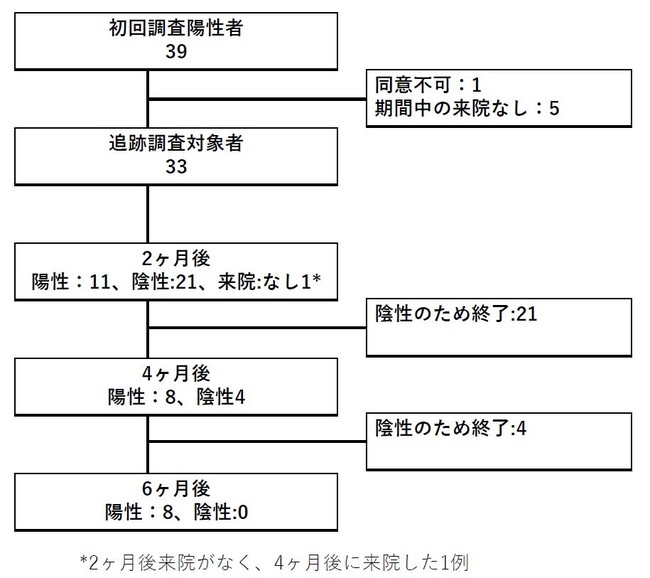
昨年の調査にて抗体陽性が確認され、今回追跡調査が可能だった全33例におけるIgG抗体の陽性率は、抗体陽性判明2ヶ月後 11/32 (34.4%)、4ヶ月後 8/33 (24.2%) 、6ヶ月後8/33 (24.2%)でした。また、抗体陽性継続の要因を解析したところ、飲酒習慣がないこと、高血圧症の治療に使われる薬剤であるアンジオテンシンⅡ受容体拮抗薬(ARB)を使っていることは、抗体が継続する要因である可能性が示唆されました。
これまで新型コロナウイルスに自然感染する人が国民の7割を超えると、集団免疫が成立するのではないかという期待がありました。しかし、今回の結果からは自然免疫による抗体は半年で約2割まで低下しており、抗体が長期間に持続することはないことがわかりました。このことから、自然感染による集団免疫が期待できないことが明らかになりました。
有効な薬剤が広く早期に使用できない現状では、ワクチン接種を広く進めていくことが重要であると考えます。
これまで新型コロナウイルスに自然感染する人が国民の7割を超えると、集団免疫が成立するのではないかという期待がありました。しかし、今回の結果からは自然免疫による抗体は半年で約2割まで低下しており、抗体が長期間に持続することはないことがわかりました。このことから、自然感染による集団免疫が期待できないことが明らかになりました。
有効な薬剤が広く早期に使用できない現状では、ワクチン接種を広く進めていくことが重要であると考えます。
これまでに、新型コロナウイルスに感染した患者の抗体継続状況については、いくつかの報告があります。4ヶ月~6ヶ月までは維持されるという報告もあれば[1-5]、短期間で減弱する報告もあり[6-8]、一様ではありませんでした。一方で、重症だった症例ほど、高力価の抗体ができることや[1,3,6,9]、抗体を長期間維持できることなども報告されていました [3,4]。しかし、無症候での抗体の獲得とその継続については報告がなく、調査を実施しました。
神奈川県内科医学会では、神奈川県内の65施設において、2020年5月18日から6月24日までに医師・看護師および通院患者、検診受診者等1,603名の調査をした結果、2.4 %が不顕性感染による抗体獲得をしていたことを報告しました[10]。この抗体が陽性だった被検者のうち、追跡調査の協力に同意が得られた33名を対象に、抗体陽性判明2ヶ月後、4ヶ月後、6ヶ月後の抗体の有無を調査しました。
検出キットは、シカイムノテスト SARS-CoV-2 IgG[11]を用いました。これは横浜市立大学学術院医学群微生物学 梁明秀教授と関東化学株式会社の共同研究により開発された、COVID-19罹患者の血清中に含まれる抗SARS-CoV-2ヒト抗体(IgG)を検出する試薬です。本キットは、イムノクロマト法の原理に基づいております。
本人が気付かないうちに感染して抗体を得ていた39名のうち、研究参加の同意が得られた33名の追跡調査を実施しました。抗体陽性継続率は、2ヶ月後11/32(34.4%)、4ヶ月後8/33(24.2%)、6ヶ月後8/33(24.2%)でした。
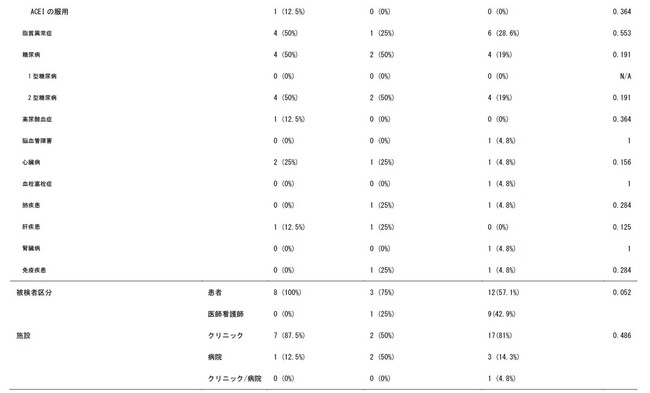
2ヶ月後に抗体が陽性から陰性に変わってしまったグループ、4ヶ月後に抗体が陽性から陰性に変わってしまったグループ、6ヶ月後も抗体陽性が継続していたグループに分けて、被検者の背景情報を比較した結果、飲酒習慣がないこと、高血圧症の治療に使われる薬剤であるアンギオテンシンⅡ受容体拮抗薬(ARB)を使っていることは、抗体が継続する要因である可能性が示唆されました。
-----------------------
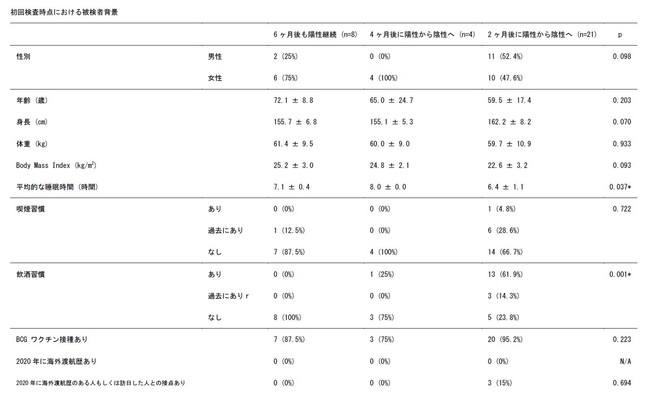

データは平均値±標準偏差、もし く症例数(割合)で示まし た。
名義尺度は Fisher の正確率検定にてし 、連続変数は一元配置分散析法の正確率検定にてし 、連続変数は一元配置分散析法まし た。
-----------------------
飲酒習慣と免疫の持続に関しては、1日あたりのアルコール摂取量が10〜20 g増加すると、市中肺炎のリスクが8%上昇するという報告があります [12]。また、別の研究においても、アルコールの摂取により免疫力を損なう可能性があることが報告されています[13-15]。千葉大学の研究では、頻繁なアルコール摂取は、ワクチン接種後の血清抗SARS-CoV-2S抗体価の低下と関連していると報告されています[16]。 ワクチンの抗体価はスパイクタンパク質(Sタンパク)にて評価されるため、本研究におけるヌクレオカプシドタンパク(Nタンパク)による評価とは検査方法が異なりますが、同様の傾向を示しました。
また、SARS-CoV-2は、侵入の際に細胞の表面に存在するアンジオテンシンⅡ受容体に結合します[17]。ACE阻害薬とARBがCOVID-19の悪化を防ぐ可能性があることを示唆した報告もあれば[18-20]、影響はないという論文もあります[21]。患者がARBを内服すると、負のフィードバックが働き、アンギオテンシンⅡ受容体数が増加します。ウイルスの結合箇所が多いことが、抗体の継続に影響している可能性があります。
今後、大規模かつ長期的な研究による、さらなる報告が待たれます。
※本研究では、ヌクレオカプシドタンパク(Nタンパク)を認識する抗体を検出するキットを用いました。現在日本で使われているワクチンはスパイクタンパク(Sタンパク)を標的としております。このため、ワクチンの効果の持続とは異なりますので、ご注意ください。
文責;神奈川県内科医学会 学術部会長 松葉育郎
References
1. Gudbjartsson DF, Norddahl GL, Melsted P, et al. Humoral Immune Response to SARS-CoV-2 in Iceland. N Engl J Med. 383: 1724-1734, 2020.
2. Demonbreun AR, McDade TW, Pesce L, et al. Patterns and persistence of SARS-CoV-2 IgG antibodies in a US metropolitan site. medRxiv. 2020. https://www.medrxiv.org/content/10.1101/2020.11.17.20233452v1 (accessed 19 February 2021).
3. Chen Y, Zuiani A, Fischinger S, et al. Quick COVID-19 Healers Sustain Anti-SARS-CoV-2 Antibody Production. Cell. S0092-8674(20)31458-6, 2020
4. Wajnberg A, Amanat F, Firpo A, et al. Robust neutralizing antibodies to SARS-CoV-2 infection persist for months. Science. 28: eabd7728, 2020
5. Lumley SF, Donnell DO’, Stoesser NE, et al. Antibodies to SARS-CoV-2 are associated with protection against reinfection. medRxiv. 2020. https://doi.org/10.1101/2020.11.18.20234369 (accessed 19 February 2021)
6. Robbiani DF, Gaebler C, Muecksch F, et al. Convergent antibody responses to SARS-CoV-2 in convalescent individuals. Nature 584: 437–442, 2020.
7. Long QX, Tang XJ, Shi QL, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med. 26: 1200–1204, 2020.
8. Nag DS, Chaudhry R, Mishra M, Rai S, Gupta M. A Prospective Study on Rapidly Declining SARS-CoV-2 IgG Antibodies Within One to Three Months of Testing IgG Positive: Can It Lead to Potential Reinfections? Cureus. 12: e11845, 2020.
9. Tjan LH, Nagano T, Furukawa K, et al. The Trend of Neutralizing Antibody Response Against SARS-CoV-2 and the Cytokine/Chemokine Release in Patients with Differing Severities of COVID-19: All Individuals Infected with SARS-CoV-2 Obtained Neutralizing Antibody. medRxiv. 2020. https://doi.org/10.1101/2020.08.05.20168682 (accessed 19 February 2021)
10. Matsuba I, Hatori N, Koido N, et al. Survey of the current status of subclinical coronavirus disease 2019 (COVID-19). J Infect Chemother. 26: 1294-1300, 2020.
11. Yokohama City University, Research team led by YCU professor successfully develops a rapid diagnostic test for COVID-19 that can detect antiviral antibodies in patient serum. https://www-user.yokohama-cu.ac.jp/~english/index.php/2020/03/27/research-team-led-by-ycu-professor-successfully-develops-a-rapid-diagnostic-test-for-covid-19-that-can-detect-antiviral-antibodies-in-patient-serum/ (accessed 1 July 2021).
12. Simou E, Britton J, Leonardi-Bee J. Alcohol and the risk of pneumonia: a systematic review and meta-analysis. BMJ Open. 8: e022344, 2018.
13. Messingham KA, Faunce DE, Kovacs EJ. Alcohol, injury, and cellular immunity. Alcohol. 28: 137-49, 2002.
14. de Almeida JM, Pazmino VFC, Novaes VCN, et al. Chronic consumption of alcohol increases alveolar bone loss. PLoS One. 15: e0232731, 2020.
15. Xu M, Wang S, Ren Z, et al. Chronic ethanol exposure enhances the aggressiveness of breast cancer: the role of p38gamma. Oncotarget. 7: 3489-505, 2016.
16. Kageyama T, Ikeda K, Tanaka S, et al. Antibody responses to BNT162b2 mRNA COVID-19 vaccine in 2,015 healthcare workers in a single tertiary referral hospital in Japan. MedRxiv. doi: https://doi.org/10.1101/2021.06.01.21258188
17. Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 181: 281-292.e6, 2020.
18. Liu Y, Yang Y, Zhang C, et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci China Life Sci. 63:364-374, 2020.
19. Matsuzawa Y, Ogawa H, Kimura K, et al. Renin–Angiotensin System Inhibitors and Severity of Coronavirus Disease-2019 in Kanagawa, Japan: A Retrospective Cohort Study. Hypertens Res. 43: 1257-1266, 2020.
20. Semenzato L, Botton J, Drouin J, et al. Antihypertensive Drugs and COVID-19 Risk: A Cohort Study of 2 Million Hypertensive Patients. Hypertension. 77:833-842, 2021.
21. Morales DR, Conover MM, You SC, et.al. Renin-angiotensin system blockers and susceptibility to COVID-19: an international, open science, cohort analysis. Lancet Digit Health. 3: e98-e114, 2020.
※図表を含むプレスリリースは下記よりダウンロードできます。
https://prtimes.jp/a/?f=d65155-20211030-d37764b3771e6cd2e42f4fd776a0e0d2.pdf
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
