メディデータ、DCT導入加速に向けPatient Cloudソリューションのサービスを強化、ePROを活用した国内の臨床試験が3倍に増加
● メディデータ・ソリューションズのePROを導入した国内の臨床試験数が2017年比約3倍に増加
● 今後の臨床試験におけるトレンドターゲットとしてeConsentの導入が加速
● メディデータは、Patient Cloudソリューションの各種機能におけるサービスおよびサポート体制を一層強化
● 今後の臨床試験におけるトレンドターゲットとしてeConsentの導入が加速
● メディデータは、Patient Cloudソリューションの各種機能におけるサービスおよびサポート体制を一層強化
世界的な新型コロナウィルス感染症拡大の中においても、e-Clinical Trial(電子技術を活用した臨床試験)テクノロジー市場は、2020から2027年の間に8.9%の成長(年平均成長率(CAGR)が見込まれており、日本においても同様に、2020年から2027年の間に8.2%(CAGR)の成長が見込まれています。(*1) 世界的なe-Clinical Trialsの増加の流れを受け、日本でもテクノロジーの利活用は一層進むと考えられており、メディデータは従来のePROにとどまらず、eConsentを含むPatient Cloudソリューションに注力したビジネスを一層本格化してまいります。
メディデータのePROを活用した国内の臨床試験数は2017年比約3倍に増加
ePROはリアルタイム性の高いデータ収集やデータクリーニング、転記にかかる時間やコスト削減が期待できることに加え、近年、臨床試験のあり方を考える上で重視される「患者中心」の実現を支えるテクノロジーとして患者体験改善の一環として導入が進んでいます。
メディデータが提供するPatient CloudソリューションはグローバルのTop Pharma 20社中19社が導入しています。同ソリューションカテゴリの中で最も多くの試験に導入されているモジュールはePRO(Medidata eCOA)で、世界59カ国で600本以上の臨床試験に当社のePROが導入されています。(*2)
日本国内では、2013年の実試験での導入を皮切りに、ePROの導入実績数は年々増加しています。国内の製薬会社によるメディデータのePRO導入試験は、2020年に導入された試験数では2017年比約3倍となり、累計導入社数は2017年の8社から2020年28社へ急増、うち半数以上がすでに複数の試験にePROを採用するなど、この数年で導入試験数は飛躍的に増加しました。対象となる疾患領域も多岐に渡り、がんや感染症・抗ウイルス・ワクチンなどを含む14領域でメディデータのePROが導入されています。2021年も昨年と同程度の試験開始が見込まれており、ePROの導入を前提とした試験は今後も拡大する見込みです。
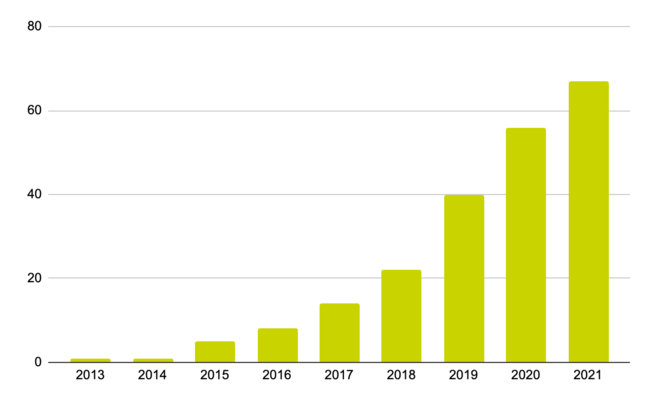
日本国内におけるePRO(Medidata eCOA)累計導入試験数の推移
(出典:メディデータ・ソリューションズ株式会社 売上実績データ 2021年9月時点)
自社国内初となるeConsent試験がスタート、次期ターゲットとて注力
患者中心のニーズに応えるための施策としてeConsent導入を検討している企業は年々増えています。今後、ePROだけでなくeConsentの導入の加速が見込まれることから、メディデータは日本国内におけるeConsentのサポートを強化してまいります。
eConsentは、従来の紙媒体での同意説明文書に代わりモバイルデバイスや動画を用いた電子的な同意説明文書の閲覧・視聴・同意取得を可能にするソリューションです。メディデータのMedidata eConsentは、EDC(電子的臨床検査情報収集)システムとのシームレスな連携により、eConsentでの同意取得および治験責任医師による確認が完了するとデータがEDCシステムに反映され、被験者登録まで自動化されています。これにより、スクリーニング状況のリアルタイムでの把握や、最適なICFバージョンでの署名状況などがEDCシステム上で確認できるようになっています。
メディデータのeConsent試験は、世界13カ国で190本以上の導入実績があります。(*2)日本でも、これまでeConsent導入を検討していた多くの企業が、2020年以降、実試験採用を前提とした検討に進み、2021年には国内初となるeConsentを導入した試験が開始されました。
Medidata eConsentアプリケーションおよび同意説明のジェネリック動画(治験参加における一般的な同意説明についての動画コンテンツ)の日本語対応も既に開始しており、導入に向けたプロジェクト支援など日本国内でのサポート体制の整備を進めています。
分散型臨床試験に適した患者ポータル「myMedidata」
myMedidataは、メディデータの社員および患者で構成するPatient Insights teamが中心となって開発した、患者中心の実現をサポートする患者ポータルです。単一のポータルサイトでPatient Journeyのあらゆるフェーズの管理をウェブベースで実施でき、遠隔地からの試験参加やサイトビットの負担軽減のためのツールとして活用できます。
このmyMedidataにはePROおよびeConsent機能が含まれており、通常のePRO(Medidata eCOA)やMedidata eConsentと同様に日本語での利用をサポートしています。また、2021年8月に発表されたビデオ通話機能の日本語対応など、国内における分散型臨床試験(DCT)のeConsentの需要の高まりに備えたサポートの拡充を進めてまいります。
メディデータはダッソー・システムズの完全子会社です。ダッソー・システムズは 3DEXPERIENCE プラットフォームにより、研究から商業化までのエンドツーエンドの科学・ビジネスプラットフォームを提供することで、個別化医療時代におけるライフサイエンスのデジタルトランスフォーメーションをリードする役割を担っています。
メディデータについて
メディデータは、より多くの患者さんの希望を実現できるよう、ライフサイエンス分野におけるデジタルトランスフォーメーションを推進しています。新しい治療の価値最大化、リスク最小化、アウトカム最適化のために、製薬企業、バイオテクノロジー企業、アカデミア、医療診断・機器メーカーなどが日々取り組んでいる研究において、エビデンスを見出し、新たなインサイトを獲得できるよう支援しています。メディデータが提供しているClinical Cloud Platformは、1,900社以上のライフサイエンス企業や団体に採用され、100万人以上の認定ユーザーが利用しており、臨床開発、コマーシャルさらにはリアルワールドデータの活用において世界で最も使われているプラットフォームです。メディデータは、米国ニューヨークに本社を置く、ダッソー・システムズ(ユーロネクスト・パリ:FR0014003TT8、DSY.PA)の傘下のグループ企業であり、世界各国に拠点を置き、各国またはグローバルでの臨床試験ニーズにお応えしております。より詳細な情報はwww.medidata.com/jp、LinkedIn / Facebookの日本語公式アカウントページなどをご覧ください。
Medidata および Medidata Rave は、ダッソー・システムズ(ユーロネクスト・パリ: #13065, DSY.PA)傘下のMedidata Solutions, Inc.の登録商標です。
ダッソー・システムズ について
ダッソー・システムズは3DEXPERIENCEカンパニーとして、人々の進歩を促す役割を担います。当社は持続可能なイノベーションの実現に向けて、企業や人々が利用する3Dのバーチャル コラボレーション環境を提供しています。当社のお客様は、3DEXPERIENCEプラットフォームとアプリケーションを使って現実世界のバーチャル ツイン エクスペリエンスを生み出し、さらなるイノベーション、学び、生産活動を追求しています。ダッソー・システムズ・グループは140カ国以上、あらゆる規模、業種の29万社以上のお客様に価値を提供します。より詳細な情報は、http://www.3ds.com(英語)、http://www.3ds.com/ja(日本語) をご参照ください。
3DEXPERIENCE、Compassアイコン、3DSロゴ、CATIA、BIOVIA、GEOVIA、SOLIDWORKS、3DVIA、ENOVIA、NETVIBES、MEDIDATA、CENTRIC PLM、3DEXCITE、SIMULIA、DELMIA およびIFWEは、アメリカ合衆国、またはその他の国における、ダッソー・システムズ (ヴェルサイユ商業登記所に登記番号B 322 306 440 で登録された、フランスにおける欧州会社) またはその子会社の登録商標または商標です。
*1 : e-Clinical Trial Technologies - Global Market Trajectory & Analytics
https://www.researchandmarkets.com/reports/2228027/eclinical_trial_technologies_global_market?utm_source=BW&utm_medium=PressRelease&utm_code=9jmpgx&utm_campaign=1436624+-+Global+e-Clinical+Trial+Technologies+Market+Trajectory+%26+Analytics%2c+2012-2019+%26+2020-2027&utm_exec=chdo54prd
*2:メディデータ・ソリューションズ 2021年6月時点の実績データ
メディデータのePROを活用した国内の臨床試験数は2017年比約3倍に増加
ePROはリアルタイム性の高いデータ収集やデータクリーニング、転記にかかる時間やコスト削減が期待できることに加え、近年、臨床試験のあり方を考える上で重視される「患者中心」の実現を支えるテクノロジーとして患者体験改善の一環として導入が進んでいます。
メディデータが提供するPatient CloudソリューションはグローバルのTop Pharma 20社中19社が導入しています。同ソリューションカテゴリの中で最も多くの試験に導入されているモジュールはePRO(Medidata eCOA)で、世界59カ国で600本以上の臨床試験に当社のePROが導入されています。(*2)
日本国内では、2013年の実試験での導入を皮切りに、ePROの導入実績数は年々増加しています。国内の製薬会社によるメディデータのePRO導入試験は、2020年に導入された試験数では2017年比約3倍となり、累計導入社数は2017年の8社から2020年28社へ急増、うち半数以上がすでに複数の試験にePROを採用するなど、この数年で導入試験数は飛躍的に増加しました。対象となる疾患領域も多岐に渡り、がんや感染症・抗ウイルス・ワクチンなどを含む14領域でメディデータのePROが導入されています。2021年も昨年と同程度の試験開始が見込まれており、ePROの導入を前提とした試験は今後も拡大する見込みです。
日本国内におけるePRO(Medidata eCOA)累計導入試験数の推移
(出典:メディデータ・ソリューションズ株式会社 売上実績データ 2021年9月時点)
自社国内初となるeConsent試験がスタート、次期ターゲットとて注力
患者中心のニーズに応えるための施策としてeConsent導入を検討している企業は年々増えています。今後、ePROだけでなくeConsentの導入の加速が見込まれることから、メディデータは日本国内におけるeConsentのサポートを強化してまいります。
eConsentは、従来の紙媒体での同意説明文書に代わりモバイルデバイスや動画を用いた電子的な同意説明文書の閲覧・視聴・同意取得を可能にするソリューションです。メディデータのMedidata eConsentは、EDC(電子的臨床検査情報収集)システムとのシームレスな連携により、eConsentでの同意取得および治験責任医師による確認が完了するとデータがEDCシステムに反映され、被験者登録まで自動化されています。これにより、スクリーニング状況のリアルタイムでの把握や、最適なICFバージョンでの署名状況などがEDCシステム上で確認できるようになっています。
メディデータのeConsent試験は、世界13カ国で190本以上の導入実績があります。(*2)日本でも、これまでeConsent導入を検討していた多くの企業が、2020年以降、実試験採用を前提とした検討に進み、2021年には国内初となるeConsentを導入した試験が開始されました。
Medidata eConsentアプリケーションおよび同意説明のジェネリック動画(治験参加における一般的な同意説明についての動画コンテンツ)の日本語対応も既に開始しており、導入に向けたプロジェクト支援など日本国内でのサポート体制の整備を進めています。
分散型臨床試験に適した患者ポータル「myMedidata」
myMedidataは、メディデータの社員および患者で構成するPatient Insights teamが中心となって開発した、患者中心の実現をサポートする患者ポータルです。単一のポータルサイトでPatient Journeyのあらゆるフェーズの管理をウェブベースで実施でき、遠隔地からの試験参加やサイトビットの負担軽減のためのツールとして活用できます。
このmyMedidataにはePROおよびeConsent機能が含まれており、通常のePRO(Medidata eCOA)やMedidata eConsentと同様に日本語での利用をサポートしています。また、2021年8月に発表されたビデオ通話機能の日本語対応など、国内における分散型臨床試験(DCT)のeConsentの需要の高まりに備えたサポートの拡充を進めてまいります。
 eConsentでの同意取得に関する画面(動画表示)
eConsentでの同意取得に関する画面(動画表示)
 eConsentでの同意取得に関する画面(動画表示)
eConsentでの同意取得に関する画面(動画表示)
 eConsentでの同意取得に関する画面(理解度の確認)
eConsentでの同意取得に関する画面(理解度の確認)
メディデータはダッソー・システムズの完全子会社です。ダッソー・システムズは 3DEXPERIENCE プラットフォームにより、研究から商業化までのエンドツーエンドの科学・ビジネスプラットフォームを提供することで、個別化医療時代におけるライフサイエンスのデジタルトランスフォーメーションをリードする役割を担っています。
メディデータについて
メディデータは、より多くの患者さんの希望を実現できるよう、ライフサイエンス分野におけるデジタルトランスフォーメーションを推進しています。新しい治療の価値最大化、リスク最小化、アウトカム最適化のために、製薬企業、バイオテクノロジー企業、アカデミア、医療診断・機器メーカーなどが日々取り組んでいる研究において、エビデンスを見出し、新たなインサイトを獲得できるよう支援しています。メディデータが提供しているClinical Cloud Platformは、1,900社以上のライフサイエンス企業や団体に採用され、100万人以上の認定ユーザーが利用しており、臨床開発、コマーシャルさらにはリアルワールドデータの活用において世界で最も使われているプラットフォームです。メディデータは、米国ニューヨークに本社を置く、ダッソー・システムズ(ユーロネクスト・パリ:FR0014003TT8、DSY.PA)の傘下のグループ企業であり、世界各国に拠点を置き、各国またはグローバルでの臨床試験ニーズにお応えしております。より詳細な情報はwww.medidata.com/jp、LinkedIn / Facebookの日本語公式アカウントページなどをご覧ください。
Medidata および Medidata Rave は、ダッソー・システムズ(ユーロネクスト・パリ: #13065, DSY.PA)傘下のMedidata Solutions, Inc.の登録商標です。
ダッソー・システムズ について
ダッソー・システムズは3DEXPERIENCEカンパニーとして、人々の進歩を促す役割を担います。当社は持続可能なイノベーションの実現に向けて、企業や人々が利用する3Dのバーチャル コラボレーション環境を提供しています。当社のお客様は、3DEXPERIENCEプラットフォームとアプリケーションを使って現実世界のバーチャル ツイン エクスペリエンスを生み出し、さらなるイノベーション、学び、生産活動を追求しています。ダッソー・システムズ・グループは140カ国以上、あらゆる規模、業種の29万社以上のお客様に価値を提供します。より詳細な情報は、http://www.3ds.com(英語)、http://www.3ds.com/ja(日本語) をご参照ください。
3DEXPERIENCE、Compassアイコン、3DSロゴ、CATIA、BIOVIA、GEOVIA、SOLIDWORKS、3DVIA、ENOVIA、NETVIBES、MEDIDATA、CENTRIC PLM、3DEXCITE、SIMULIA、DELMIA およびIFWEは、アメリカ合衆国、またはその他の国における、ダッソー・システムズ (ヴェルサイユ商業登記所に登記番号B 322 306 440 で登録された、フランスにおける欧州会社) またはその子会社の登録商標または商標です。
*1 : e-Clinical Trial Technologies - Global Market Trajectory & Analytics
https://www.researchandmarkets.com/reports/2228027/eclinical_trial_technologies_global_market?utm_source=BW&utm_medium=PressRelease&utm_code=9jmpgx&utm_campaign=1436624+-+Global+e-Clinical+Trial+Technologies+Market+Trajectory+%26+Analytics%2c+2012-2019+%26+2020-2027&utm_exec=chdo54prd
*2:メディデータ・ソリューションズ 2021年6月時点の実績データ
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像