鼻腔(鼻の入口)からの自己採取が可能な新型コロナウイルス(SARS-CoV-2) TMA法検査薬「アプティマ SARS-CoV-2」10 月12日販売開始

より簡単な検体採取の手法と、安全性と精度の両面の確保が求められる今、ホロジック社の「アプティマ SARS-CoV-2」は「Aptima Multitestスワブ採取セット」とパンサーシステムにより、鼻腔から採取した検体について核酸抽出から測定までを全自動で行うことができます。これには ①鼻腔(鼻の入り口)からの採取は医師監視下では患者自身でも採取が可能、②医療従事者への感染リスクを低減、③統一された検体採取チューブにより検査フローが円滑化する、というメリットがあります。
さらなるメリットとして、ウイルスを不活化できる専用チューブに検体を採取することで、採取時、および輸送時の感染リスクが減少します。また全自動遺伝子検査装置パンサーシステムによる完全自動化で処理能力が向上します。(1日1000テスト/1台)
ホロジックジャパンは、「アプティマ SARS-CoV-2」および「Aptima Multitestスワブ採取セット」の日本国内における供給を月間15万テスト分まで増強する体制を整えております。当製品の普及と安定供給を通じてより多くの方が必要な時に検査が受けられる体制の拡充に貢献し、新型コロナウイルス感染症の拡大防止と医療従事者の負担軽減に寄与してまいります。
[製品情報]
希望販売価格:アプティマ SARS-CoV-2 250テスト(250テスト) 1,500,000円(税抜)
希望販売価格:アプティマ SARS-CoV-2 コントロール(1箱) 150,000円(税抜)
販売名:アプティマ SARS-CoV-2 承認番号:30200EZX00057000
使用検体:※厚生労働省公表の「新型コロナウイルス感染症(COVID-19)病原体検査の指針(第1版)」*2を参照ください
販売名:Aptima Multitestスワブ採取セット 医療機器届出番号:13B1X10179002006
※当スワブは鼻腔検体専用です(鼻咽頭ぬぐい液検体は採取不可)
*1 販売用の製品が準備でき次第、順次体外診断用医薬品の販売を開始いたします。体外診断用医薬品「アプティマ SARS-CoV-2」と研究用試薬「Aptima SARS-CoV-2」のSARS-CoV-2検出性能に違いはありません。
*2 「新型コロナウイルス感染症(COVID-19)病原体検査の指針(第1版)」 https://www.mhlw.go.jp/content/000678571.pdf
<ご参考資料>
【製品特長】
(1) TMA法により検体:鼻腔、鼻咽頭ぬぐい液、口腔咽頭中のSARS-CoV-2のRNAを検出します。
(2) 対象配列:SARS-CoV-2に特異的な遺伝子配列(ORF1ab)の2つの領域を同時に検出することで変異による偽陰性のリスクを低減しています。
(3) パンサーシステムにより検体からの核酸抽出~ウイルスの検出までを全自動で行います。検査従事者のハンズオンタイムを削減するとともに、検体容器に触れる時間を短くすることで従事者の安全にも貢献します。
(4) パンサーシステムで各キットの試薬のタグを読み取り、使用回数、有効期限などを一元管理します。
COVID-19の保険適用について
令和2年10月2日付け「検査料の点数の取扱いについて」(保医発1002第1号)が参照する厚生労働省の定める新型コロナウイルス感染症の検査に係る指針※により鼻腔検体に対するSARS-CoV-2 核酸検出は医科診療報酬(検体検査)の算定を受け得る検査となりました。
※参考資料 「新型コロナウイルス感染症(COVID-19)病原体検査の指針(第1版)」
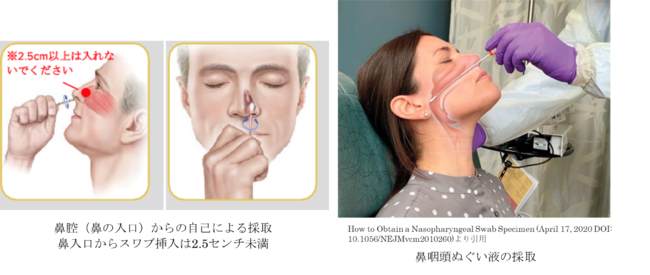
鼻腔(鼻甲介付近)からの検体採取で患者と医療従事者の双方にメリット:安全性と精度の両立
海外の状況:米国感染症学会(IDSA;Infectious Diseases Society of America)のCOVID-19の診断ガイドラインでは患者による鼻腔検体の自己採取は安全性を確保しつつ、鼻咽頭ぬぐい液と同程度の精度を示すことが期待できるとの推奨を受けています*3。

| 検体種 | 日本国内の状況 | 採取時のメリットデメリット |
| 唾液 | 「新型コロナウイルス感染症(COVID-19)病原体検査の指針(第1版)」に記載 | ・医療従事者の管理下で患者の自己採取が可能 ・医療従事者への感染リスクが低い |
| 鼻腔(鼻甲介付近) | 「新型コロナウイルス感染症(COVID-19)病原体検査の指針(第1版)」に記載 | ・医療従事者の管理下で患者の自己採取が可能(鼻の入り口から2cm程度) ・医療従事者への感染リスクが低い |
| 鼻咽頭ぬぐい液 | 「新型コロナウイルス感染症(COVID-19)病原体検査の指針(第1版)」に記載 | ・採取時の侵襲性がより高い ・採取時にくしゃみなどにより医療従事者への感染リスクがある |
鼻腔(鼻甲介付近)からの採取は医療従事者の管理下で行う場合、患者自身が採取できます。
*3 鼻腔の自己採取検体は医師が採取した鼻腔検体と同等の感度・特異度を示す(GRADEレベル:Low)ことが記載されています。Infectious Diseases Society of America Guidelines on the Diagnosis of COVID-19 Table5, https://www.idsociety.org/practice-guideline/covid-19-guideline-diagnostics/
https://hologic.co.jp/products/diagnostics/aptima_sars_cov-2.html
検体の不活化により検体搬送時の感染リスクを減少、完全自動化で処理能力を向上
採取した時点で検体中のウイルスを不活化できるAptima Multitestスワブ採取セットの専用チューブにより、採取時、および輸送時の感染リスクも低減できます。
ホロジック社の全自動遺伝子検査装置パンサーシステム(1台)を使えば、臨床検査技師1人で1日に1,000テストを実施できます。装置が2台、3台あれば、単純にこのテスト数は2倍、3倍に増加します。(1人で複数台扱うことが可能)。

[TMA法について]
TMA法(Transcription Mediated Amplification)はPCR法(polymerase chain reaction)と同じく核酸増幅法のひとつで、逆転写酵素とRNAポリメラーゼ(RNA合成酵素)を利用することで等温下で標的の核酸を大量に増幅させます。感染症などの検出系への応用を目指して開発、実用化された核酸検査法です。
例えば、ホロジック社のTMA法による試薬を用いた子宮頸がんにおけるHPV(ヒトパピローマウイルス)検査は、PCR法と同等の感度を有しつつ、高い特異度を示すことが報告されています*。
*J Cuzick et al., Comparing the performance of six human papillomavirus tests in a screening population. (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3590662/)
[パンサーシステムについて]
~臨床における核酸増幅法の使用をより多くの施設で可能に~
「パンサーシステム」は、遺伝子検査の完全自動化を実現した、全自動の遺伝子解析装置です。
検体到着後、専用ラックに検体をセットし装置に投入するだけで、核酸の抽出・増幅・検出・結果報告までの一連の工程、および核酸増幅反応によって得られた核酸増幅産物の不活性化処理までを全自動で行います。最初の測定結果はHIV-1, HBV, HCVで2時間40分、他の項目では3.5時間で得られるほか、最大275検体を8時間、500検体を12時間で測定することが可能であり、オペレーターの作業時間を大幅に削減します。
またランダムアクセス機能により、単一のラック内であっても複数の検査項目を測定できるとともに、随時、検体を投入することができるため、それぞれの種類の検体を溜めて待機するなどの手間を省き、最適なワークフローを実現します。必要な機器類をコンパクトに集約した一体型のデザインによりラボにおける設置スペースを有効に活用することが可能です。
販売名: パンサーシステム
医療機器届出番号:13BX10179002001
[ホロジック社(Hologic, Inc.)について]
世界的な医療、診断分野のリーディングカンパニーとして最先端技術をお客様に提供することで全ての人と医療の現場に「より確かな安心」をお届けできるよう日々技術革新に取り組んでおります。ホロジック社(本社:アメリカマサチューセッツ州)は1986年に創立し、現在、約6,400人以上の従業員を抱える年間売上高3,400億円のグローバルヘルスケアカンパニーに成長しました。診断・遺伝子検査(Diagnostics Solutions)、マンモグラフィ・骨密度測定(Breast & Skeletal Health Solutions)、婦人科用外科手術(GYN Surgical Solutions)、の3つの分野を主要領域とし、“The Science of Sure”を企業理念とし、臨床的成果を向上し、より革新的な製品開発を実現するために、継続的な成長を目指して取り組みます。
[ホロジックジャパン株式会社について]
2002年にアメリカの体外診断薬・機器企業Third Wave Technologies社の日本支社として設立。2004年株式会社サードウェイブジャパンへ改組、2012年10月にホロジックジャパン株式会社に社名変更し、体外診断用医薬品・医療機器、マンモグラフィシステム、乳房生検装置などを主力事業として活動しています。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
