非代償性肝硬変に対する肝疾患治療用細胞シートを共同開発
〜 カノンキュア社の先端的研究に、ひろさきLIの臨床開発と薬事戦略を融合 〜
ひろさきLI株式会社(本社:青森県弘前市、代表取締役社長:石川博樹、以下「当社」)は、カノンキュア株式会社(本社: 鳥取県米子市、代表取締役:汐田剛史、以下「カノンキュア社」)が研究開発を進めている、現在有効な治療法のない非代償性肝硬変を対象とする肝疾患治療用細胞シート(開発名「KCS-003」)の再生医療等製品としての製造販売承認取得に向けて共同開発契約を締結しましたのでお知らせいたします。
共同開発の背景:カノンキュア社が肝硬変に対する有望な治療薬(KCS-003)を独自開発
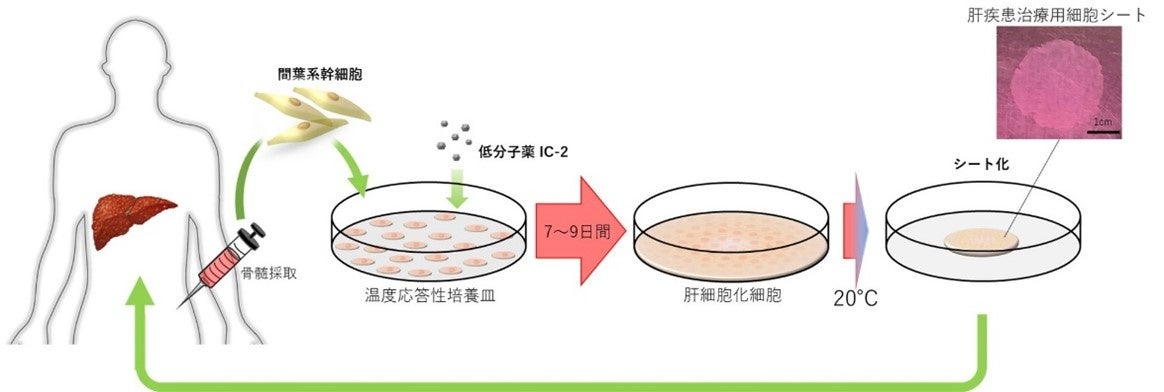
肝硬変患者数は我が国で約130,000⼈と推定されますが、有効な治療法がありません。また、肝移植の適応患者数は年間約2,500⼈と言われておりますが、ドナー不⾜のため肝移植を受けられる⽅は年間で約500例に過ぎず、肝硬変による死亡者数は年間約17,000⼈に上ります。そこで、⿃取⼤学医学部遺伝⼦医療学分野の汐⽥剛史教授(カノンキュア社 代表取締役)らは、⽣体内にある間葉系幹細胞を独⾃に開発した低分⼦薬により肝細胞化させ、細胞シートとして移植するKCS-003を開発しました。KCS-003は動物試験の結果、肝表⾯に貼付することで、肝硬変の線維成分を著明に減少させ、肝臓の線維化を抑制することがわかりました。このことから、KCS-003の移植は肝硬変の有効な治療法となるのみでなく、肝癌の発⽣を抑える効果も期待されます。
共同開発の目的:ひろさきLI社の臨床開発力と薬事戦略により再生医療等製品の承認取得を狙う
当社は、国内外の上場企業グループに属さない独立した未上場の企業として、初めて再生医療等製品であるヒト羊膜基質使用ヒト(自己)口腔粘膜由来上皮細胞シート「サクラシー®」の製造販売承認を取得し、保険適用されました。また、自己軟骨細胞加工製品(開発名「IK-01」)の開発を進めており、再生医療等製品の開発及び製造販売承認取得に関して多くのノウハウを蓄積しております。
今回KCS-003の共同開発にあたっては、カノンキュア社の先端的な研究開発技術に加えて、これまで当社において蓄積した臨床開発・製造販売申請における技術を融合することで、一日も早い製造販売承認取得に向けて着実に開発を進めてまいります。
肝疾患治療用細胞シート作製の概要
【カノンキュア株式会社について】
カノンキュア社(https://kanoncure.com/)は、2016年に設立された鳥取県米子市を拠点に、肝疾患を対象とした再生医療等製品や医薬品を創出する研究開発型創薬ベンチャーです。骨、軟骨、脂肪に分化する間葉系幹細胞を独自に開発した低分子化合物IC-2を用い肝細胞化する独自技術によって製造した肝疾患治療用細胞シートを、治療法のない非代償性肝硬変の治療薬として上市を目指しています。カノンキュア社は、これまで治療法のなかった肝硬変患者さまへの新たな光となるべく、肝疾患を対象とした再生医療等製品や医薬品を創出する事業を精力的に展開しています。
【ひろさきLI株式会社について】
当社(http://www.hirosaki-li.co.jp/)は、2015年に青森県弘前市発の再生医療ベンチャーとして設立され、再生医療等製品2品目の開発・製造・販売を行っています。
ヒト羊膜基質使用ヒト(自己)口腔粘膜由来上皮細胞シート(サクラシー®)は、角膜幹細胞疲弊症(角膜が結膜上皮によって覆われて眼瞼と癒着する疾患)を対象として、2022年1月に製造販売承認を取得し、2022年9月に保険適用されました。また自己軟骨細胞加工製品(IK-01)は、外傷性軟骨損傷と変形性膝関節症を対象として臨床試験を実施中です。またCYBERDYNE株式会社との資本業務提携により、再生医療等製品の開発・製造における新たな価値創出に向けて事業を展開しています。
当社は、患者さまとそのご家族が豊かな日常生活を取り戻し、笑顔あふれる人生となるよう貢献すべく、画期的な再生医療等製品をより早く提供できるように挑戦し続けます。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
