自家培養口腔粘膜上皮「オキュラル®」:保険収載了承のお知らせ
12月1日から保険収載へ 両眼の角膜上皮幹細胞疲弊症治療の新たな選択肢に
「オキュラル®」は、角膜上皮幹細胞疲弊症※1によって角膜が広範囲に障害を受け、視力が著しく低下した患者さまに対する新たな治療法として期待されています。
当社は、「再生医療をあたりまえの医療に」をビジョンに掲げ、既存製品のさらなる普及に加え、新たな再生医療等製品を継続的に開発・上市することを通じて、再生医療の産業化を推進するとともに、患者さまの生活の質(QOL)の向上に貢献していきます。
【保険償還価格(2021年12月1日収載予定)】

| ①組織運搬セット※2 ②培養口腔粘膜上皮パッケージ※3 |
4,280,000 円 5,470,000 円 |
【特長】
1.口腔粘膜上皮細胞を用いて角膜上皮幹細胞疲弊症を治療する、世界初の再生医療等製品。
2.大阪大学から技術導入して実用化した国産の製品。
3.根本的な治療法の存在しなかった角膜上皮疾患に対する治療の選択肢が拡大。当社既承認製品である自家培養角膜上皮「ネピック®」※4の適応対象外の患者さまの治療が可能。
【背景・経緯】
本品の開発において、大阪大学大学院医学系研究科(脳神経感覚器外科学(眼科学))の西田幸二教授、大家義則講師らにより、AMED※5からの支援を受けて、医師主導治験が実施されました。当社は、西田幸二教授が世界に先駆けて開発した自家培養口腔粘膜上皮細胞シート移植の技術を導入するとともに、当該医師主導治験を引き継ぎ、2016年9月より「オキュラル®」の企業治験を行ってきました。2020年9月には、眼科領域における第2号の
再生医療等製品として、厚生労働省へ製造販売承認申請を行い、2021年6月に製造販売承認を取得しました。「オキュラル®」は、2020年に角膜上皮幹細胞疲弊症の治療を目的とした希少疾病用再生医療等製品※6に指定されております。
尚、「オキュラル®」の販売は、眼科医療機器メーカーである株式会社ニデック(愛知県蒲郡市、代表取締役社長:小澤 素生)が行う予定です。
【保険収載の概要】

| 販売名 | オキュラル® |
| 保険収載日 | 2021年12月1日 |
| 保険償還価格 | ①組織運搬セット 4,280,000 円 ②培養口腔粘膜上皮パッケージ 5,470,000 円 |
| 決定区分 | C2(新機能・新技術) |
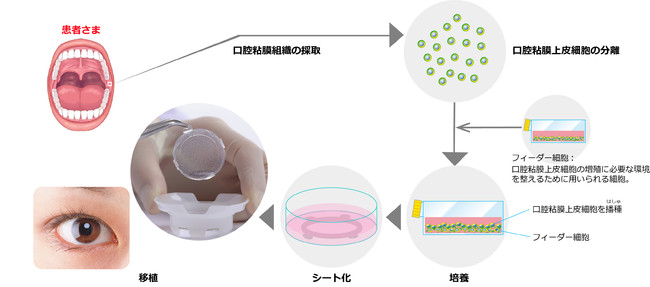
| 主な使用目的 | 本品は、患者自身の口腔粘膜組織を採取し、分離した口腔粘膜上皮細胞を培養し、シート状に形成して患者自身に使用する「自家培養口腔粘膜上皮」である。本品の適応は角膜上皮幹細胞疲弊症であり、患者の角膜輪部領域を含む眼表面に適用し、角膜上皮を修復することを目的とする。 |
| 留意事項案 | 150ヒト自家移植組織 (6)自家培養口腔粘膜上皮 ア 角膜上皮幹細胞疲弊症であって、重症度StageⅡA(結膜瘢痕組織の除去(必要に応じて羊膜移植)を行ったにもかかわらず角膜上皮の再建に至らない場合に限る。)、StageⅡB又はStageⅢの患者に対して使用した場合に、片眼につき1回に限り算定できる。 イ 自家培養口腔粘膜上皮・調製・移植キットは、次のいずれにも該当する医師が使用した場合に限り算定する。 a 眼科の経験を5年以上有しており、角膜移植術を術者として5例以上実施した経験を有する常勤の医師であること。 b 所定の研修を修了していること。なお、当該研修は、次の内容を含むものであること。 ⅰ 自家培養口腔粘膜上皮の適応に関する事項 ⅱ 角膜上皮幹細胞疲弊症の重症度判定に関する事項 ⅲ 口腔粘膜組織採取法に関する事項 ⅳ 移植方法に関する事項 ウ 自家培養口腔粘膜上皮・採取・培養キットは、口腔粘膜組織採取法に 関する研修を修了している医師が使用した場合に限り算定する。 エ ヒト自家移植組織(自家培養口腔粘膜上皮)を使用した患者については、診療報酬請求に当たって、診療報酬明細書に角膜上皮幹細胞疲弊症の重症度を含めた症状詳記を添付する。 |
【自家培養口腔粘膜上皮「オキュラル®」の移植】
【業績見通し】
当社は、本件に係る事業計画について、2021年5月11日付「中期経営計画(事業計画及び成長可能性に関する事項)」にて公表しており、計画どおりに進行しているため、2022年3月期通期業績予想には影響しません。今後、当社の業績に重大な影響を与える新たな事実が判明した場合は、速やかにお知らせいたします。
※1 結膜と角膜の境界領域である角膜輪部に存在する角膜上皮幹細胞が、先天的又は外的要因等によって消失することで発症する疾患。角膜が混濁し、視力の低下や、眼痛等の臨床症状が見られます。
※2 患者さまの口腔粘膜組織を採取した後、細胞培養が終了するまでに使用される材料から構成されるキット。
※3 細胞の培養が終了した後、シート状に調製し、移植し終えるまでに使用される材料から構成されるキット。
※4 「ネピック®」は、患者さま自身の角膜輪部組織から角膜上皮幹細胞を採取してシート状に培養したもので、本品を移植することにより角膜上皮を再建させることを目的としています。「ネピック®」は2020年6月に保険収載され、株式会社ニデックが販売を行っています。
※5 国立研究開発法人日本医療研究開発機構。
※6 医薬品医療機器等法に基づき厚生労働大臣より指定された、希少疾病を対象とする再生医療等製品です。当該
指定を受けた場合には、試験研究費に対する助成金の交付、優先的な治験相談および優先審査の実施、再審査期間の延長等の優遇措置が受けられます。希少疾病用再生医療等製品の指定には、当該再生医療等製品の用途に係る対象患者数が本邦において 5 万人未満であること、また、代替する適切な治療法が無い、既存の治療法と比較して著しく高い有効性又は安全性が期待されるなどの医療上特に優れた使用価値を有することが必要とされています。
(参考:当社について)

| 当社は、「再生医療をあたりまえの医療に」をビジョンに掲げる再生医療メーカーです。日本の再生医療のトップランナーとして、2007年10月に日本初の再生医療等製品となる自家培養表皮「ジェイス®」の製造販売承認を取得し、2009年1月より販売を開始しました。また、2012年7月には自家培養軟骨「ジャック®」、2020年3月には自家培養角膜上皮「ネピック®」、2021年6月には自家培養口腔粘膜上皮「オキュラル®」の製造販売承認を取得しました。尚、「ジャック®」は整形外科、「ネピック®」は眼科の領域で日本初となる再生医療等製品です。国内で承認されている再生医療等製品13品目の内、4品目が当社製品です。 |
以上
【本件に関するお問い合わせ先】
株式会社ジャパン・ティッシュ・エンジニアリング 経営企画部
TEL 0533-66-2020
E-mail jtec-info@jpte.co.jp
詳しくは、ホームページhttp://www.jpte.co.jp/をご覧ください。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
- 種類
- 経営情報
- ビジネスカテゴリ
- 医薬・製薬
- キーワード
- 再生医療眼科領域自家培養口腔粘膜上皮
- ダウンロード
