他家(同種)培養表皮「Allo-JaCE03」:治験開始のお知らせ
当社初の他家細胞製品 患者さまへいち早く提供可能なレディメイド製品の実現に向けて治験届提出
株式会社ジャパン・ティッシュ・エンジニアリング(本社:愛知県蒲郡市、代表取締役社長執行役員:畠 賢一郎)は、本日、他家(同種)培養表皮(開発名:Allo-JaCE03、以下「Allo-JaCE03」)の治験計画届書を独立行政法人医薬品医療機器総合機構に提出しましたのでお知らせします。
当社は、「Allo-JaCE03」の開発を通じて医療機器に関する知見・ノウハウを獲得し、他家細胞(他人の細胞)を用いる領域へ事業展開を拡げてまいります。当社は、「再生医療をあたりまえの医療に」をビジョンに掲げ、既存製品のさらなる普及に加え、新たな再生医療等製品及び医療機器を継続的に開発・上市することを通じて、再生医療の産業化を推進するとともに、患者さまの生活の質(QOL)の向上に貢献していきます。
当社は、「Allo-JaCE03」の開発を通じて医療機器に関する知見・ノウハウを獲得し、他家細胞(他人の細胞)を用いる領域へ事業展開を拡げてまいります。当社は、「再生医療をあたりまえの医療に」をビジョンに掲げ、既存製品のさらなる普及に加え、新たな再生医療等製品及び医療機器を継続的に開発・上市することを通じて、再生医療の産業化を推進するとともに、患者さまの生活の質(QOL)の向上に貢献していきます。
記
【製品概要】
【治験概要】
本治験は、皮膚欠損の代表的疾患である深達性Ⅱ度熱傷(DDB)の患者を対象とし、「Allo-JaCE03」の有効性の検証ならびに安全性の確認を目的とします。今後当社は、京都大学医学部附属病院ほか、全5施設にて治験を実施していく予定です。
【製品特長】
① 原材料が他家細胞であることから、一定品質を満たす製品を大量かつ計画的に生産することができます。
② 培養品を乾燥させることで室温・長期保存が可能となり、医療機関でストックし、レディメイド(事前に製造・保存しておき、必要な時に遅滞なく使用することができる)で使用可能です。
③ 本品は生きた細胞を含まない医療機器です。当社は、本品が他家製品・乾燥品である特長を生かし、国内だけでなく海外市場への展開も加速させていきます。
【背景・経緯】
当社は2007年に、重症熱傷を適応対象として、日本初の再生医療等製品となる自家培養表皮「ジェイス®」の製造販売承認を取得しました。その後、2009年より「ジェイス®」を販売開始したことにより患者さまの救命率は向上しました。しかし、重症熱傷をはじめとする皮膚欠損創は、受傷後速やかに創閉鎖して全身状態を安定させることが必要です。既存の治療法には以下の課題があります。当社は、これらの課題を解決すべく「Allo-JaCE03」の開発を進めています。
① 「ジェイス®」は、患者さま自身の皮膚を原材料としたオーダーメイド製品であり、製造に3週間を要するため、重症例では移植前に患者さまが死亡に至ることも少なくないこと。
② 既存の創傷被覆材は、治療効果に限界があること。自家皮膚移植は、患者さまへの侵襲性が高いこと。
③ 重症熱傷の治療は医療費が非常に高額となるため、社会保障費の観点からも治療期間の短縮が望まれていること。
さらに、他家製品の開発においては、原料供給の課題があります。当社の「Allo-JaCE03」の製品化ならびにヒト他家細胞の安定供給に向けた体制構築への取り組みは、国立研究開発法人 日本医療研究開発機構(AMED)の助成事業として採択されており、国からの支援を受けながら、原料供給の課題解決に向けて取り組んでいます。
2021年8月25日開示「令和 3 年度「医工連携イノベーション推進事業 開発・事業化事業」事業採択のお知らせ」
https://ssl4.eir-parts.net/doc/7774/tdnet/2019316/00.pdf
2021年6月15日開示「令和 3 年度「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生医療等製品用ヒト(同種)体性幹細胞原料の安定供給促進事業)」事業採択のお知らせ」
https://ssl4.eir-parts.net/doc/7774/tdnet/1989270/00.pdf
【業績見通し】
当社は、本件に係る事業計画について、2021年5月11日付「中期経営計画(事業計画及び成長可能性に関する事項)」にて公表しており、計画どおりに進行しているため、2022年3月期通期業績予想には影響しません。今後、当社の業績に重大な影響を与える新たな事実が判明した場合は、速やかにお知らせいたします。
(参考:当社について)
当社は、「再生医療をあたりまえの医療に」をビジョンに掲げる再生医療メーカーであり、2021年3月から帝人グループの一員です。
日本の再生医療のトップランナーとして、2007年10月に日本初の再生医療等製品となる自家培養表皮「ジェイス®」の製造販売承認を取得し、2009年1月より販売を開始しました。また、2012年7月には自家培養軟骨「ジャック®」、2020年3月には自家培養角膜上皮「ネピック®」、2021年6月には自家培養口腔粘膜上皮「オキュラル®」の製造販売承認を取得しました。尚、「ジャック®」は整形外科、「ネピック®」は眼科の領域で日本初となる再生医療等製品です。国内で承認されている再生医療等製品14品目の内、4品目が当社製品です。
以上
【本件に関するお問い合わせ先】
株式会社ジャパン・ティッシュ・エンジニアリング 経営企画部
TEL 0533-66-2020
E-mail jtec-info@jpte.co.jp
https://www.jpte.co.jp/
【製品概要】
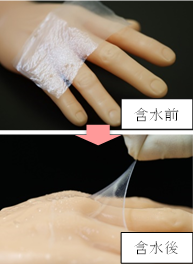 他家(同種)培養表皮
他家(同種)培養表皮
「Allo-JaCE03」は、健常なヒト皮膚組織由来の表皮細胞シートを乾燥したものです。含水することで弾力性のある乾燥前の物性に戻ります。高い生体親和性を持ち、早期の創傷治癒を目的として使用します。
【治験概要】
本治験は、皮膚欠損の代表的疾患である深達性Ⅱ度熱傷(DDB)の患者を対象とし、「Allo-JaCE03」の有効性の検証ならびに安全性の確認を目的とします。今後当社は、京都大学医学部附属病院ほか、全5施設にて治験を実施していく予定です。
【製品特長】
① 原材料が他家細胞であることから、一定品質を満たす製品を大量かつ計画的に生産することができます。
② 培養品を乾燥させることで室温・長期保存が可能となり、医療機関でストックし、レディメイド(事前に製造・保存しておき、必要な時に遅滞なく使用することができる)で使用可能です。
③ 本品は生きた細胞を含まない医療機器です。当社は、本品が他家製品・乾燥品である特長を生かし、国内だけでなく海外市場への展開も加速させていきます。
【背景・経緯】
当社は2007年に、重症熱傷を適応対象として、日本初の再生医療等製品となる自家培養表皮「ジェイス®」の製造販売承認を取得しました。その後、2009年より「ジェイス®」を販売開始したことにより患者さまの救命率は向上しました。しかし、重症熱傷をはじめとする皮膚欠損創は、受傷後速やかに創閉鎖して全身状態を安定させることが必要です。既存の治療法には以下の課題があります。当社は、これらの課題を解決すべく「Allo-JaCE03」の開発を進めています。
① 「ジェイス®」は、患者さま自身の皮膚を原材料としたオーダーメイド製品であり、製造に3週間を要するため、重症例では移植前に患者さまが死亡に至ることも少なくないこと。
② 既存の創傷被覆材は、治療効果に限界があること。自家皮膚移植は、患者さまへの侵襲性が高いこと。
③ 重症熱傷の治療は医療費が非常に高額となるため、社会保障費の観点からも治療期間の短縮が望まれていること。
さらに、他家製品の開発においては、原料供給の課題があります。当社の「Allo-JaCE03」の製品化ならびにヒト他家細胞の安定供給に向けた体制構築への取り組みは、国立研究開発法人 日本医療研究開発機構(AMED)の助成事業として採択されており、国からの支援を受けながら、原料供給の課題解決に向けて取り組んでいます。
2021年8月25日開示「令和 3 年度「医工連携イノベーション推進事業 開発・事業化事業」事業採択のお知らせ」
https://ssl4.eir-parts.net/doc/7774/tdnet/2019316/00.pdf
2021年6月15日開示「令和 3 年度「再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(再生医療等製品用ヒト(同種)体性幹細胞原料の安定供給促進事業)」事業採択のお知らせ」
https://ssl4.eir-parts.net/doc/7774/tdnet/1989270/00.pdf
【業績見通し】
当社は、本件に係る事業計画について、2021年5月11日付「中期経営計画(事業計画及び成長可能性に関する事項)」にて公表しており、計画どおりに進行しているため、2022年3月期通期業績予想には影響しません。今後、当社の業績に重大な影響を与える新たな事実が判明した場合は、速やかにお知らせいたします。
(参考:当社について)
当社は、「再生医療をあたりまえの医療に」をビジョンに掲げる再生医療メーカーであり、2021年3月から帝人グループの一員です。
日本の再生医療のトップランナーとして、2007年10月に日本初の再生医療等製品となる自家培養表皮「ジェイス®」の製造販売承認を取得し、2009年1月より販売を開始しました。また、2012年7月には自家培養軟骨「ジャック®」、2020年3月には自家培養角膜上皮「ネピック®」、2021年6月には自家培養口腔粘膜上皮「オキュラル®」の製造販売承認を取得しました。尚、「ジャック®」は整形外科、「ネピック®」は眼科の領域で日本初となる再生医療等製品です。国内で承認されている再生医療等製品14品目の内、4品目が当社製品です。
以上
【本件に関するお問い合わせ先】
株式会社ジャパン・ティッシュ・エンジニアリング 経営企画部
TEL 0533-66-2020
E-mail jtec-info@jpte.co.jp
https://www.jpte.co.jp/
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
