抗体ペアが抗原分子上に反応場をつくり出す
2つの抗体エピトープを利用したテンプレート反応の開発
特定の場所だけで化学反応を起こす技術は、医薬品開発研究や生体内での薬物治療法の開発等に利用できるため、様々な反応の開発が進んでいます。研究グループでは、『エピトープ均質化抗体パネル』と呼ばれるNIBIOHNの技術を利用して、特定の蛋白質の複数の異なる部分(エピトープ)を抗原として認識する抗体を複数取得しました。これらの抗体のうち、結合する抗原の場所が近接した抗体を2つ用い、それぞれに互いに反応する官能基を修飾しました。これらの抗体が抗原に結合した際のみに特定の化学反応が進行することを、明らかにしました。この成果から、生体内で利用できる反応の開発が進むことが期待されます。
本研究成果は、2023年5月31日に国際学術誌「Angewandte Chemie International Edition」にオンライン掲載されました。
1.背景
特定の場所で化学反応を引き起こす技術は、化合物スクリーニングをはじめとした医薬品開発研究に大きく貢献してきました。特に、ある特定の分子(=テンプレート)を標的に、2つの反応性部位が当該分子上でのみ反応するテンプレート化学反応は、生体内での薬物活性化による治療法、分子検出等の多彩なアプリケーションとしての利用に期待が集まっています。一方で、これまでにテンプレートとして用いられる分子の種類は限られてきました。特に、創薬等を目的とした場合に、テンプレートとして有用と考えられる蛋白質については、酵素反応ポケット等を除けばテンプレートにすることが困難であり、2つの反応性部位を近づけるような補助をしない限り実現することは困難でした。
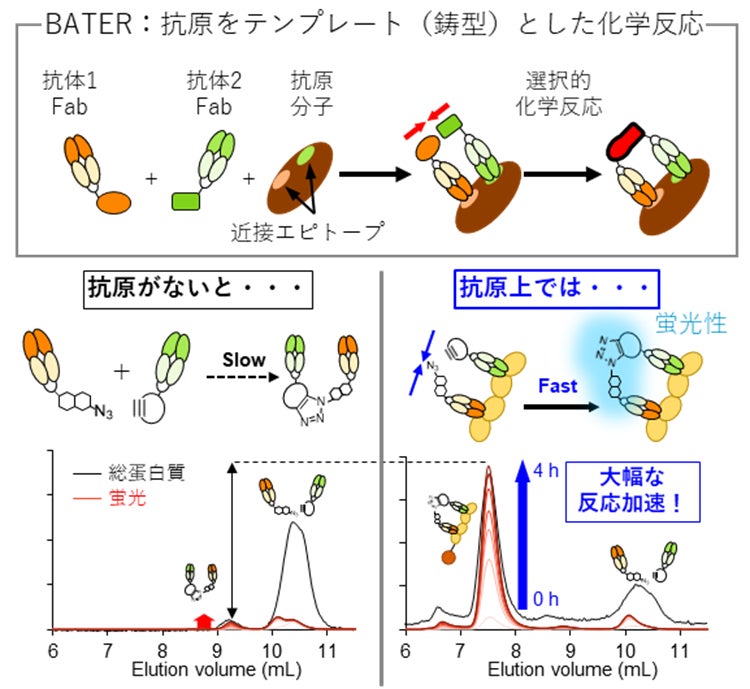
私たちは、これまで蛋白質をテンプレートとして用いる方法の実現が困難であったのは、2つの反応性部位を近づける最適な方法が見つかっていないためではないかと考えました。特に抗原-抗体結合を利用する方法は、抗体の高い特異性を利用することが可能である一方、抗体そのものが直径5 nm程度と比較的大きいために、反応点同士を十分に近接させる設計が容易ではないという問題がありました。
一方で、研究グループのNIBIOHN 創薬デザイン研究センターには、エピトープ*1均質化抗体パネル(ENAP)*2という技術があります。ENAPは、抗体取得・選別法を最適化することによって、抗原の多様なエピトープを網羅するように多数の抗体を取得することができます。本研究でテンプレートとした蛋白質(2型TNF受容体[TNFR2])は、制御性T細胞に主に発現する医薬品標的分子ですが、本研究に先立って、TNFR2に対するENAPから、多様なエピトープに結合する抗体を取得しています(特許7054209)。研究グループではこれまでに、ENAPに属する複数の抗体の中から2つの抗体のエピトープ結合領域(パラトープ)を組み合わせたバイパラトピック抗体*3を作製し、これを医薬品候補として開発する研究を進めてきました(特許7101433、bioRxiv preprint, doi:10.1101/2022.12.15.520217)。これらの作用メカニズムを解析する中で、抗原上の近接した位置に同時結合することのできる抗体ペアを見出していました。これを利用すれば、反応性部位を十分に近接させることができるのではないかと考えました。
2.研究手法・結果
(研究の手法について)
(1)本研究ではまず、TNFR2に結合する2つの抗体から取得される抗原結合フラグメント(Fab)に対して、互いに反応するような生体直交型反応性官能基*4を導入しました。この際、反応によって発蛍光性*5となるような工夫をすることで、反応進行過程を容易にモニターできるようにしました。また、FabのC末端に1つだけ官能基を導入し、反応位置を限定させることで、テンプレート反応の精度を高める設計としました。
(2) 続いて、2つの抗体が抗原であるTNFR2と相互作用した際に、TNFR2をテンプレートとした化学反応を引き起こせるかどうかを検証することにしました。このために、2つの抗体をTNFR2と混合して反応の進行を観察しました。
(研究の結果について)
背景で述べたように、近接したエピトープに同時に相互作用する抗体ペアを利用した場合に、反応時間に応じた蛍光強度の上昇が観察されました。これは、テンプレート反応が設計通りに進んだことを意味しています。一方で、相互作用するエピトープの位置関係が異なり、2つの抗体が近接しない場合には、蛍光強度の上昇速度が極めて遅くなることがわかりました。また、TNFR2が存在しない状況においても、テンプレート反応は進行しないことを確認しました。
以上の結果から、適切なエピトープに結合する抗体を2つ用いることで、抗原をテンプレートとする化学反応を起こすことができることが明らかになりました。私たちはこれを「Biepitopic Antigen-Templated chemical Reaction: BATER」と名付けました。この結果は、抗原-抗体相互作用のみを駆動力として、テンプレート反応を実現した初めての成果です。
3.波及効果、今後の予定
本研究成果を利用することで、抗原検出センサーの開発や、次世代型の抗体医薬品開発につながると考えています。一方でこれまでの取組は、プロトタイプとしての概念実証でしかありませんので、BATERが観察される条件を厳密に規定するための検討や、利用可能な反応性官能基を広げる検討等を含め、基礎研究から、医薬品の応用に向けた研究まで、多方面にわたる研究を展開していきたいと考えています。
4.研究プロジェクトについて
京大院薬とNIBIOHNは、2020年7月に包括的な連携協定を締結しました(参考:https://www.kyoto-u.ac.jp/ja/news/2020-07-10-1)。本研究は連携拠点として京大院薬に設置された実践創薬プロジェクトに所属するバイオ医薬品化学分野を中心に、両機関の共同で実施された研究です。本研究は日本学術振興会 科学研究費助成事業・基盤研究C「化学的連結法による低分子化抗体ターゲティングシステムの開発」(代表 秋葉宏樹)、日本医療研究開発機構 創薬基盤推進研究事業「バイパラトピック抗体のパネル化による機能的人工抗体の探索デザインの高度化」(代表 秋葉宏樹)、同 生命科学・創薬研究支援基盤事業(BINDS)「精密合成技術に基づくハイブリッド型ニューモダリティ創製の創薬支援」(代表 竹本佳司)等の支援を受けて実施されました。
<用語解説>
*1エピトープ:抗体が認識する抗原が蛋白質等の大きな分子の場合には、抗原表面には抗体が認識しうる場所が複数存在します。抗体が認識する抗原表面の部分のことをエピトープと呼び、同じ抗原に結合する抗体であっても、エピトープが異なる場合には、薬理活性等様々な性質が異なることが知られています。
*2 エピトープ均質化抗体パネル(ENAP):ターゲットとする抗原分子と相互作用する非常に多数の抗体の中から、有用な機能を最も強力に発揮する抗体を取りこぼしなく取得するNIBIOHN独自の技術です。本研究では、多彩なエピトープに結合する抗体群を取得・同定できるというENAPの特徴を利用して、抗原テンプレート反応を効率よく進行させるために最適なエピトープを選別する重要な技術基盤として利用しています。
*3 バイパラトピック抗体:2つのパラトープ(エピトープに結合する領域)をもつ改変抗体です。通常の抗体は、全く同じ抗原結合フラグメント(Fab)を2つもちます。バイパラトピック抗体は一方を2つのFabが異なるエピトープを認識するように、違う抗体由来のFabを連結した分子です。通常の抗体に他のパラトープを付加したものもバイパラトピック抗体と呼ばれますが、いずれも天然には存在しない、人工的な改変を施した分子です。
*4 生体直交型反応:生体内には化学的に活性で、反応しうる部分(官能基)をもつ分子が豊富に存在しています。これらの活性官能基とは反応せずに、互いに選択的に反応するような2つの官能基の間で生じる化学反応を、生体直交型反応と呼びます。
*5 発蛍光性:蛍光とは特定の波長の光を当てた際に、異なる波長の光が観察される現象です。化学反応の前には蛍光を生じず、反応によって蛍光を生じる性質を、発蛍光性と呼びます。
<研究者のコメント>
本研究は、京大院薬とNIBIOHNの連携によって初めて実現することができました。これまでに進めてきた実用化志向の創薬研究の実から採取したタネが、新しい技術の芽を出しました。花が咲き次の実がなるまで、大切に育てたいと思います。(秋葉宏樹)
<論文タイトルと著者>
タイトル:A Proximity-Induced Fluorogenic Reaction Triggered by Antibody–Antigen Interactions with Adjacent Epitopes(隣接するエピトープに結合する抗体-抗原相互作用を引き金とする近接誘導発蛍光反応)
著 者:西山健太郎、秋葉宏樹、永田諭志、津本浩平、鎌田春彦、大野浩章
掲 載 誌:Angewandte Chemie International Edition DOI:10.1002/anie.202306431
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
