米インサイト社、パルサクリシブの即効的かつ持続的奏効を示す最新データを発表 再発または難治性のB細胞性非ホジキンリンパ腫患者を対象として
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせていただくようお願いいたします。
・濾胞性・辺縁帯・マントル細胞リンパ腫を対象にパルサクリシブを用いるCITADEL臨床開発プログラムのデータが、第63回米国血液学会年次総会(ASH2021)の口頭発表演題に採択
・今般米国食品医薬品局(FDA)に受理された米国での新薬承認申請(US NDA)を裏付けるデータ
米国デラウェア州ウィルミントン―2021年12月11日―インサイト・コーポレーション(本社:米国デラウェア州、ナスダック:INCY、以下「インサイト」)はこのたび、いずれも再発または難治性である濾胞性リンパ腫(FL)、辺縁帯リンパ腫(MZL)、マントル細胞リンパ腫(MCL)を対象に、強力かつ高選択的な次世代型経口ホスファチジルイノシトール3キナーゼデルタ(PI3Kδ)阻害剤であるパルサクリシブ塩酸塩(以下「パルサクリシブ」)を評価する第II相臨床試験3試験のデータを発表しました(FL対象:CITADEL-203試験、MZL対象:CITADEL-204試験、MCL対象:CITADEL-205試験、いずれも現在進行中)。本データの発表は、2021年12月11~14日に米国ジョージア州アトランタで開催された第63回米国血液学会年次総会(ASH2021、ハイブリッド形式)の口頭発表演題として採択されました。
CITADEL-203・204・205試験の主要評価項目は客観的奏効率(ORR)です。主な副次評価項目は、完全奏効率(CRR)、奏効期間(DOR)、無増悪生存期間(PFS)、全生存期間(OS)、安全性、忍容性などです。放射線画像診断による評価を要する項目は、すべて独立審査委員会(IRC)の判定に基づきます。
今回の主要解析データは、前年のASH2020で発表した結果( https://investor.incyte.com/press-releases/press-releases/2020/Incyte-Announces-Parsaclisib-Treatment-Results-in-High-Rate-of-Rapid-and-Durable-Responses-in-Patients-with-Relapsed-or-Refractory-B-Cell-Non-Hodgkin-Lymphomas/default.aspx )に引き続き、パルサクリシブによる治療が即効的かつ持続的な奏効をもたらし、管理可能な安全性プロファイルを有することを示しており、今般、米国食品医薬品局(FDA)に受理された( https://investor.incyte.com/press-releases/press-releases/2021/Incyte-Announces-Acceptance-of-NDA-for-Parsaclisib-for-Three-Types-of-Relapsed-or-Refractory-Non-Hodgkin-Lymphomas/default.aspx )、パルサクリシブの米国での新薬承認申請(US NDA)の裏付けとなっています。
CITADEL試験の主なデータ:
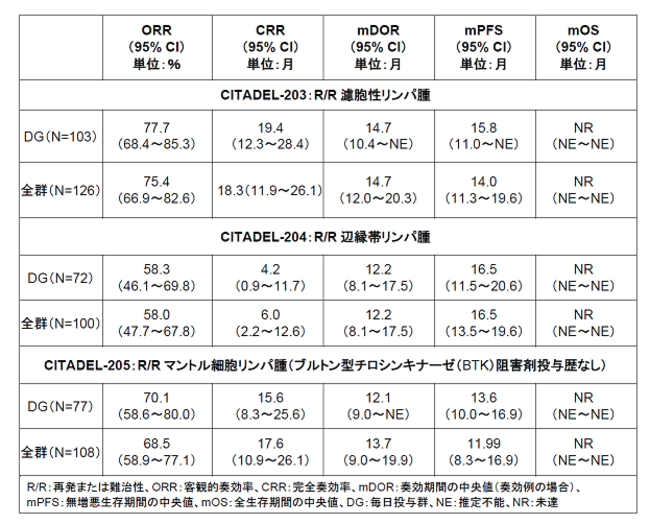
すべての試験で、パルサクリシブの忍容性はおおむね良好であり、安全性プロファイルは管理可能なレベルでした。
インサイトのGroup Vice Presidentであり、Oncology Targeted Therapies(がん分子標的療法領域)を担当する Peter Langmuir(M.D.)は、次のように述べています。「CITADEL試験の最新結果を、患者さんやがん治療に関わる医療従事者の皆さまと共有できることを、大変喜ばしく思います。今回のデータは、再発または難治性の濾胞性リンパ腫、辺縁帯リンパ腫、マントル細胞リンパ腫の患者さんにとって、パルサクリシブが有益な治療薬となる可能性を示すエビデンスを補強する、有望なものです。FDAのご協力のもと、本剤をいち早く患者さんにお届けできるよう、まい進していく所存です。」
CITADEL-204試験の治験責任医師であり、米国ミシガン大学Rogel Cancer Center血液・腫瘍部門のTycel Phillips准教授(M.D.)は、次のように述べています。「非ホジキンリンパ腫とは、米国で最もよくみられるがんの一つであり、さまざまな病型(サブタイプ)があります。現在の治療選択肢では多くのサブタイプの患者さんが治癒に至っておらず、新たな治療法が必要です。非ホジキンリンパ腫の複数種類のサブタイプにおいて、パルサクリシブによる即効的かつ持続的奏効が認められ、さらに安全性プロファイルが管理可能なレベルであったことに手応えを感じています。CITADEL試験全体を通して示された、重要な評価項目のデータは、パルサクリシブが治療選択肢として好ましい可能性を示唆するものです。」
今回の発表内容は、第63回米国血液学会年次総会(ASH2021)のウェブサイトで公開されています:https://www.hematology.org/meetings/annual-meeting
・ 口頭発表演題番号813:CITADEL-203試験
・ 口頭発表演題番号44:CITADEL-204試験
・ 口頭発表演題番号382:CITADEL-205試験
濾胞性リンパ腫、辺縁帯リンパ腫、マントル細胞リンパ腫について
非ホジキンリンパ腫は、白血球の仲間であるリンパ球で発生するがんの一種です。濾胞性リンパ腫(FL)、辺縁帯リンパ腫(MZL)、マントル細胞リンパ腫(MCL)は、B細胞性非ホジキンリンパ腫の一種です。一般に、FLとMZLは緩徐進行型の低悪性度リンパ腫に、MCLは進行が早い中悪性度リンパ腫に分類されます。一次治療後に再発または難治性であった患者さんに対する治療選択肢が、アンメットメディカルニーズとして強く望まれています。
CITADEL試験について
CITADEL(Clinical Investigation of TArgeted PI3K-DELta Inhibition in Lymphomas)臨床開発プログラムは、リンパ腫の成人患者を対象にパルサクリシブを評価する一連の開発プログラムであり、現在つぎの臨床試験が進行中です。
・CITADEL-203試験(NCT03126019: https://cts.businesswire.com/ct/CT?id=smartlink&url=https%3A%2F%2Fclinicaltrials.gov%2Fct2%2Fshow%2FNCT03126019&esheet=52343337&newsitemid=20201207005129&lan=en-US&anchor=NCT03126019&index=2&md5=c5167f233e287ca146faa26391aa87ea ):再発または難治性濾胞性リンパ腫(FL)グレード1~3aに該当し、全身療法の前治療歴(2種類以上)を有する患者を対象とする試験。適格基準は、ECOG PS(米国東海岸がん臨床試験グループのパフォーマンスステータススコア)が2以下で、造血幹細胞移植不適格な場合。
・CITADEL-204試験(NCT03144674: https://cts.businesswire.com/ct/CT?id=smartlink&url=https%3A%2F%2Fclinicaltrials.gov%2Fct2%2Fshow%2FNCT03144674&esheet=52343337&newsitemid=20201207005129&lan=en-US&anchor=NCT03144674&index=3&md5=1626ad78a9039db37a1b6b8d480dc87f ):全身療法の前治療歴(1種類以上)を有し、ブルトン型チロシンキナーゼ(BTK)阻害剤の治療歴がない、再発または難治性辺縁帯リンパ腫(MZL)患者を対象とする試験。適格基準は、ECOG PSが2以下で、放射線画像診断可能なリンパ節腫脹または節外リンパ性悪性腫瘍を有する場合(脾臓型MZLの場合は組織学的骨髄浸潤が認められること)。
なお、当初はイブルチニブの前治療歴を有する例の組み入れも可能としていたが、目標例数に満たなかったため当コホートに対する試験は実施されなかった。
・CITADEL-205試験(NCT03235544: https://cts.businesswire.com/ct/CT?id=smartlink&url=https%3A%2F%2Fclinicaltrials.gov%2Fct2%2Fshow%2FNCT03235544&esheet=52343337&newsitemid=20201207005129&lan=en-US&anchor=NCT03235544&index=4&md5=ae01e9915d9f379878cc931cfe5df08a ):全身療法の治療歴(3種類以下)を有し、再発または難治性のマントル細胞リンパ腫患者を対象とする試験(BTK阻害剤投与歴の有無は問わない)。適格基準は、ECOG PSが2以下で、放射線画像診断可能なリンパ節腫脹または節外リンパ性悪性腫瘍を有する場合。
各試験の対象患者は、パルサクリシブ20mgの1日1回8週間投与後、本剤20mgを週1回投与する群(weekly-dosing group[WG])、または本剤2.5mgを1日1回投与する群(daily-dosing group[DG])に割り付けられました。その後、毎日投与が望ましいレジメンとして選定されたため、WG群患者のDGへの変更を認めました。なお、ニューモシスチス肺炎日和見感染の予防措置を要しました。
パルサクリシブについて
パルサクリシブは、強力かつ高選択的な次世代型経口ホスファチジルイノシトール3キナーゼデルタ(PI3Kδ)阻害剤として開発中の治験薬です。現在、非ホジキンリンパ腫(濾胞性、辺縁帯、マントル細胞)および自己免疫性溶血性貧血を対象とする第II相臨床試験で、それぞれ単剤療法の評価を実施中です。また、骨髄線維症を対象としたルキソリチニブ併用ピボタル試験が進行中です。さらに、B細胞性悪性腫瘍を対象としたピボタル試験をはじめ、tafasitamabとの併用を評価する臨床試験を開始予定です。
2018年12月、インサイトと中国Innovent Biologics Co., Ltd.社(以下「Innovent」)は、パルサクリシブをはじめ臨床開発中の治験薬3剤について、戦略的提携の締結で合意しました。この合意に基づきInnoventは、中国本土、香港、マカオ、台湾での、パルサクリシブを含む3剤の開発・販売権を取得しています。
インサイトについて
インサイト・コーポレーション(インサイト)は、米国デラウェア州ウィルミントンに本社を置く、グローバルなバイオ医薬品企業です。自社開発治療薬の創薬、開発、販売を通じて、最も重要なアンメットメディカルニーズへのソリューションの追及に全力を尽くしています。インサイトに関する詳細な情報は、当社ウェブサイト( http://www.incyte.com/ )または当社ツイッター( https://twitter.com/Incyte )をご覧ください。
インサイト・バイオサイエンシズ・ジャパン合同会社に関する詳細は、Incyte.jp( http://www.incyte.jp/ ) をご覧ください。
将来の見通しに関する記述
本プレスリリースに記載されている過去の情報を除き、本プレスリリースに記載されている濾胞性リンパ腫、辺縁帯リンパ腫、マントル細胞リンパ腫をはじめとする非ホジキンリンパ腫患者に有益な治療法を提供するためのパルサクリシブの可能性に関する記述や、CITADEL臨床開発プログラムに加え、タファシタマブとの併用、ルキソリチニブとの併用など他のパルサクリシブの開発計画、非ホジキンリンパ腫患者におけるパルサクリシブの安全性と有効性についての記述には、予測や推定、その他の見通しに関する記述が含まれます。
こうした将来の見通しに関する記述は、当社の現時点での予測に基づくもので、リスクや不確実性から、実際の結果とは大きく異なる場合があります。またそうした予想外の展開およびリスクとしては、予期しない遅滞、今後の研究開発や臨床試験結果が薬事承認基準を満たして開発継続を保証することに失敗するか不十分なものとなる可能性、臨床試験のための十分な症例数の組み入れ能力、計画されたスケジュールに従って被験者を登録する能力、COVID-19パンデミック、およびパンデミック対策が当社の臨床試験、サプライチェーンなどの第三者提供者、販売・マーケティング活動、事業・開発・創薬活動に及ぼす影響、FDAまたはその他の規制当局による決定、当社製品の有効性および安全性、当社の製品の市場における受容度、市場における競合状況、販売・マーケティング・製造・流通の要件、予想を上回る経費、訴訟や戦略的活動に関連する経費、米国証券取引委員会に提出した報告書(2020年9月30日締め四半期に関するフォーム10-Qに記載した四半期報告書を含む)で随時詳述したその他のリスクがあります。当社にはこうした将来の見通しに関する記述を更新する意図はなく、その義務も負いません。
免責条項
本資料は、インサイト・コーポレーションが2021年12月11日に発表したプレスリリースの和文抄訳であり、内容につきましては英語原文が優先されます。本プレスリリースに記載されている医薬品情報(本邦未承認情報を含む)は、インサイト・バイオサイエンシズ・ジャパン合同会社に関連する最新情報をステークホルダーの皆様にお知らせするものであり、医薬品のプロモーションや宣伝・広告を目的とするものではありません。
プレスリリースは以下よりダウンロードできます。
https://prtimes.jp/a/?f=c-60544-2021122013-99505e9e8139ab7b5fabd671444688c5.pdf
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像