“ヒトiPS細胞から簡便かつ高効率な骨格筋分化誘導法を開発”
-病態の解明、新しい治療法開発の促進に期待-
【本研究成果のポイント】
iPS細胞から骨格筋を簡便かつ高効率に分化誘導する方法を開発しました。
抗生物質ピューロマイシンで樹立したiPS細胞は高い骨格筋分化効率を示しました。
球脊髄性筋萎縮症(SBMA)の患者由来iPS細胞から骨格筋を誘導し、一部の病態を再現することに成功しました。
電気刺激により筋収縮を示す、機能的な三次元骨格筋を構築できました。
これらの結果から、筋疾患モデルの作製が容易になり、今後の治療開発促進につながることが期待されます。
Ⅰ.研究の背景
ヒト疾患を対象とした病態解析や創薬には、患者の病態を適切に再現した疾患モデルが必要です。患者さんの皮膚や血液など、患者さん由来の組織からつくる疾患特異的なヒト人工多能性幹細胞(ヒトiPS細胞)は、体内のあらゆる種類の細胞に分化することができ、さらに患者さんの遺伝情報を保有しているため、細胞株やマウスモデルなどの既存の疾患モデルより正確に疾患の病態を再現し、病態解析や創薬において問題となる生物種の違いに伴う問題を克服できる可能性があります。そのため、ヒト疾患モデルの作製や、創薬などへの応用が期待されています。しかし、疾患特異的iPS細胞を用いたヒト疾患のモデル化を成功させるには、ヒトiPS細胞を迅速、効率的、かつ再現性よく目的の細胞に分化させる方法を開発することが極めて重要です。これまで、ヒトiPS細胞から骨格筋を分化誘導するために、ドキシサイクリン誘導型MYOD1※5を導入する手法が広く用いられてきましたが、時間と労力のかかるクローン選択※6を必要としていました。さらにクローン間で分化効率や細胞における病気の症状にばらつきが生じるといった問題があり、病態や薬効が隠されてしまう可能性がありました。そこで、我々はiPS細胞にMYOD1を導入する手法を用いて、クローン選択無しでヒトiPS細胞を骨格筋へ迅速・高効率かつ安定的に分化誘導する方法を検討しました。
Ⅱ.研究内容
我々は、ヒトiPS細胞にドキシサイクリン誘導型MYOD1遺伝子を導入し、抗生物質であるピューロマイシンによる薬剤選択を行い、ドキシサイクリン誘導性にMYOD1を発現するヒトiPS細胞株(MYOD1発現ヒトiPS細胞:MYOD1-hiPSC)を作製しました(図1)。その結果、従来行ってきたクローン選択を行わなくても、バルク培養※7で作製したMYOD1発現ヒトiPS細胞から、高効率(80%以上)に、Myogenin(MyoG)※8陽性およびミオシン重鎖(MHC)※9陽性骨格筋細胞を分化誘導し得ることを見出しました。また、バルク培養で作製したMYOD1発現ヒトiPS細胞を用いることで、クローン間のばらつきを最小限に抑えられる可能性があることを見出しました。
この方法を用いて、球脊髄性筋萎縮症(SBMA)患者由来iPS細胞を骨格筋へと分化誘導したところ、健常者株と同様に高効率に骨格筋へと分化誘導可能でした。また、健常者iPS細胞由来骨格筋に比べて速筋のマーカーであるACTN3※10遺伝子の発現が低下していることを見出しました。この結果は、SBMA患者由来骨格筋で見られる変化は、SBMA患者やSBMAモデルマウスでみられている速筋の減少をよく反映していると考えられました(図2)。したがって、この分化誘導法は疾患解析にも応用可能であることが示されました。
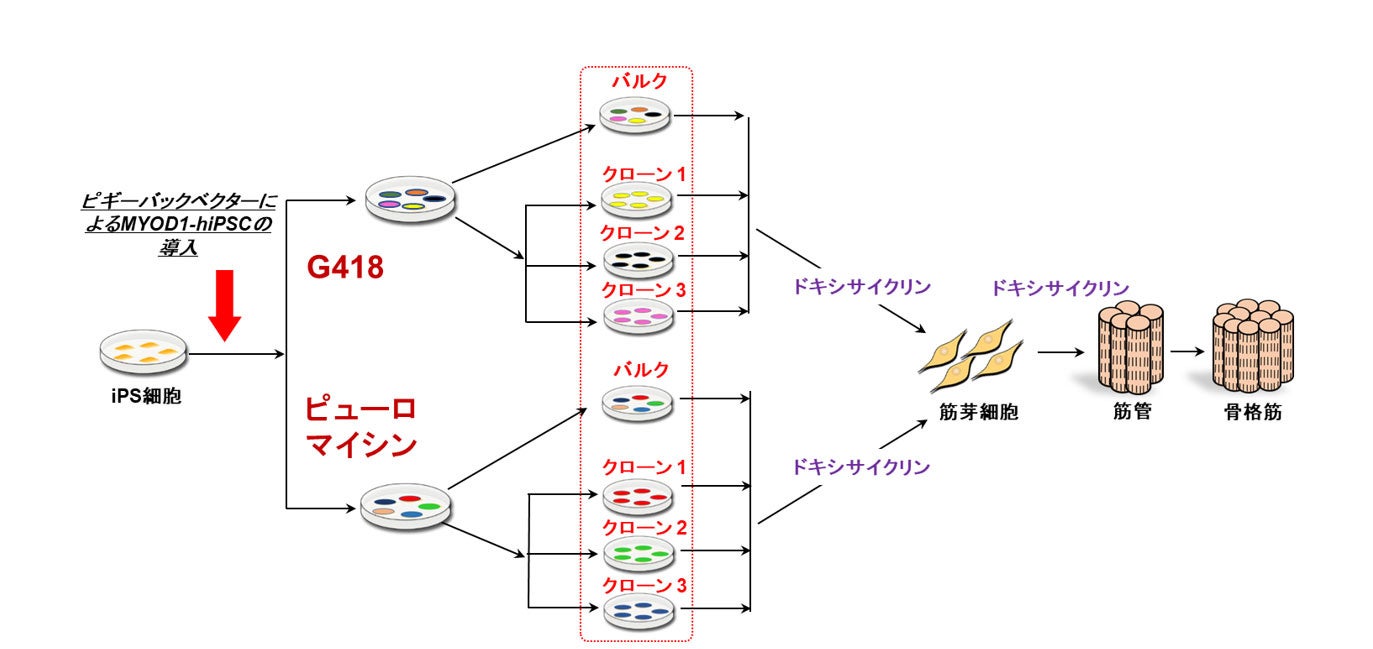
図1. ヒトiPS細胞から骨格筋への分化誘導

図2. SBMA患者由来 iPS細胞の骨格筋への分化誘導とACTN3遺伝子の発現低下(速筋の減少)
さらに、バルク培養で作成したMYOD1発現iPS細胞から三次元骨格筋を作製したところ、電気刺激により筋収縮を得ることに成功しました(図3)。したがって、この方法によりヒトiPS細胞から誘導した骨格筋は機能的であると考えられました。
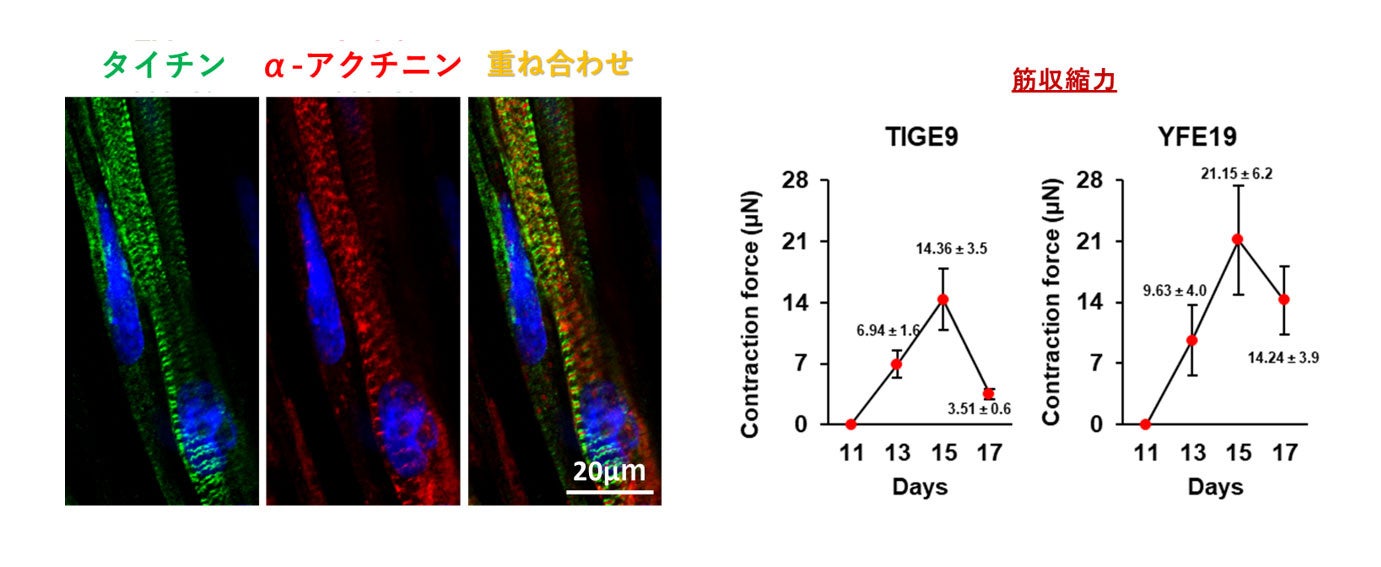
図3. 三次元骨格筋の構築と筋収縮力の検出
Ⅲ.今後の展開
今回の研究成果から、ヒトiPS細胞から簡便かつ高効率な骨格筋分化誘導法の開発に成功しました。従来のヒトiPS細胞からの骨格筋分化誘導法は、クローン選択が必要でしたが、今回バルク培養での骨格筋分化誘導法により、機能的な三次元の骨格筋を作製し得ることを示しました。既存の方法よりも時間と労力がかからず、効率的に筋疾患モデルの作製が容易になるため、今後の病態解明や治療開発の促進につながることが期待されます(図4)。
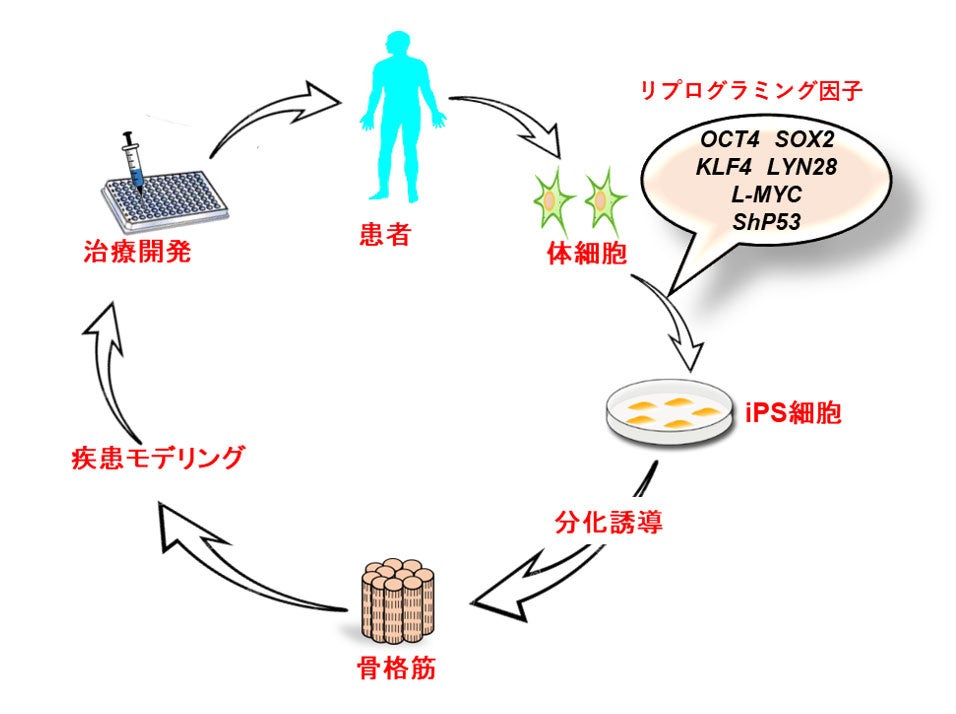
図4. 治療開発への応用
Ⅳ.用語説明
※1 分化誘導:幹細胞から別の細胞への変化を引き起こすこと。
※2 球脊髄性筋萎縮症(Spinal bulbar muscular atrophy:SBMA):成人男性に発症し嚥下障害や四肢の筋力低下・筋萎縮などが緩徐に進行する下位運動ニューロン変性疾患。
※3 三次元骨格筋:生体を模倣した立体的な骨格筋。
※4 筋疾患モデル:筋疾患と類似した症状を呈する細胞。
※5 ドキシサイクリン誘導型MYOD1:抗生物質の一つであるドキシサイクリンによって骨格筋に分化するために必要なMYOD1を発現させるシステム。
※6 クローン選択:細胞の樹立の過程で、単一細胞に由来する同一の細胞集団からなるコロニーを選んでiPS細胞株を樹立すること。
※7 バルク培養:細胞の樹立の過程で、クローン選択を行わずにMYOD1を発現する細胞を回収してくること。
※8 Myogenin(MyoG):骨格筋マーカー。筋形成などに関与する。
※9 ミオシン重鎖(MHC):骨格筋マーカー。筋収縮において重要な役割を果たしている。
※10 ACTN3(α-アクチニン 3):速筋線維に特異的に発現し、筋肉を強く動かす瞬発力に関与する。
Ⅴ.研究成果の公表
本研究成果は、令和5年5月25日(英国時間),Scientific Reports誌オンライン版として掲載されます。
論文タイトル:
Simple and efficient differentiation of human iPSCs into contractible skeletal muscles for muscular disease modeling
(筋疾患モデルのためのヒトiPS細胞による収縮可能な骨格筋への簡便かつ効率的な分化誘導)
著者:
Muhammad Irfanur Rashid1,2, 伊藤卓治1,2,3, 宮冬樹4, 下門大祐2,5, 有本加奈絵6, 小野寺一成1,2, 岡田梨奈1,2,3, 長島拓則6, 山本一貴6, Zohora Khatun1,2, Rayhanul Islam Shimul1, 丹羽淳一2, 勝野雅央7, 祖父江元8, 岡野栄之5, 櫻井英俊9, 清水一憲6, 道勇学2, 岡田洋平1,2
1. 愛知医科大学加齢医科学研究所 神経iPS細胞研究部門
2. 愛知医科大学医学部 内科学講座(神経内科)
3. 日本学術振興会
4. 慶應義塾大学医学部 臨床遺伝学センター
5. 慶應義塾大学医学部 生理学教室
6. 名古屋大学大学院工学研究科 生命分子工学専攻
7. 名古屋大学大学院医学系研究科 神経内科学
8. 愛知医科大学
9. 京都大学iPS細胞研究所 CiRA(サイラ)
DOI: 10.1038/s41598-023-34445-9
本研究は、日本医療研究開発機構(再生医療実現拠点ネットワークプログラム、疾患特異的iPS 細胞の利活用促進・難病研究加速プログラム「神経・筋相互作用を標的とした運動神経疾患の病態解明と治療開発」、難治性疾患実用化研究事業「疾患特異的iPS細胞を用いた球脊髄性筋萎縮症の新規治療薬シーズの探索」)、日本学術振興会科学研究費助成事業(JP19K07969,JP19H03576, JP20K16611,JP21K07471,JP22H02988など)、SBMAの会、堀科学芸術振興財団の支援を受けて行われました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
