iPS細胞から遺伝性難聴の原因となる内耳ギャップ結合形成細胞を作製
~難聴の再生医療と薬剤開発へ~
順天堂大学医学部耳鼻咽喉科学講座(主任教授・池田勝久)の神谷和作准教授、福永一朗研究員らの研究チームは、遺伝性難聴1*の中で最も頻度の高いGJB2(コネキシン26)変異型難聴2*の原因となる内耳ギャップ結合3*形成細胞をiPS細胞から作る技術開発に成功しました。今回開発した方法により、これまで根本的治療法が存在しなかった遺伝性難聴への薬剤スクリーニングや再生医療が可能となり、難聴研究の臨床応用を実現させる大きな成果と言えます。本研究は国際幹細胞学会の公式学会誌「Stem Cell Reports」のオンライン版2016年11月11日(日本時間)に掲載されました。
【本研究成果のポイント】
・iPS細胞から遺伝性難聴の原因となる内耳ギャップ結合形成細胞の作製法を開発
・Gjb2変異型難聴モデル動物において難聴の分子病態を再現
・遺伝性難聴に対する薬剤スクリーニングや再生医療への応用に期待
【背景】
聴覚障害は出生児1000人に1人の割合で発症し、先天性疾患の中で最も高頻度に発生する疾患の一つです。その半数以上は遺伝子変異を原因とする遺伝性難聴です。中でもGJB2(コネキシン26)変異型難聴は、遺伝性難聴の50%以上もの割合を占めています。コネキシン(CX)26は、内耳の細胞間のイオン輸送を行うギャップ結合の構成要素の一つであり(図1)、内耳リンパ液のイオン組成を保つことにより音の振動を神経活動へ変換する重要な分子ですが、その変異によりギャップ結合の構造が保てず難聴になります。
【内容】
これまで、iPS細胞などの多能性幹細胞から神経などの外胚葉性組織への分化誘導法が多く報告されています。その中に外胚葉性組織を効率よく分化させるSFEBq法(無血清凝集浮遊培養法)という三次元培養法があります。今回、私たち研究グループはSFEBq法を改良し、外胚葉性組織の中で神経組織とは異なる系統にある内耳組織、特に内耳蝸牛においてギャップ結合のネットワークを形成する内耳支持細胞群の作製を試みました。
研究チームはまずiPS細胞を外胚葉に分化させるSFEBq法の過程で、GJB2遺伝子が作るCX26というタンパク質が最も多く発現する三次元培養の条件を選抜しました。特にBMP4とTGFb阻害剤を添加した培養法でCX26発現が顕著に増加しました。この三次元培養には他の細胞も混在するため、コネキシン26ギャップ結合が形成される細胞塊を分離し、独自に開発した蝸牛由来の細胞上で培養しました。この培養法により、内耳同様の巨大なギャップ結合を均一に形成する細胞シートが作製できました(図3)。
作製した細胞シートのギャップ結合は内耳と同様に細胞間で物質を輸送する能力を持ち、内耳の発達期にみられる自発的カルシウムシグナル伝搬という特殊な機能を示しました。さらに、疾患モデル細胞としての機能を確認するため、Gjb2遺伝子を欠損させた難聴マウスのiPS細胞から内耳細胞を作ったところ、難聴発症の原因となるギャップ結合複合体が崩壊する様子が再現できました(図4)。
以上の結果から、本研究で開発した分化誘導法は、iPS細胞からGJB2変異型遺伝性難聴の疾患モデル細胞となる内耳ギャップ結合形成細胞を作製する有効な技術となります。
【今後の展開】
今回私たちが開発したiPS細胞から内耳ギャップ結合形成細胞を作製する方法は、これまで根本的治療法の存在しなかった遺伝性難聴の再生医療を可能とし、難聴研究の臨床応用を実現させる上での大きな成果であると考えます。さらに、開発した内耳細胞は、GJB2変異型遺伝性難聴の疾患モデル細胞として細胞治療法の開発に活用でき、薬剤スクリーニングや新規薬剤の有効性・安全性評価への応用も可能です。
現在、研究チームはヒトiPS細胞から内耳ギャップ結合形成細胞の作製を行っています。今後はGJB2変異型遺伝性難聴の患者さんのiPS細胞の樹立と分化誘導により、様々な変異型に応じた遺伝性難聴疾患モデル細胞を作製し、薬剤開発や再生医療を含めた総合的な難聴治療法の開発を目指していきます。
【用語説明】
1*:先天性難聴・遺伝性難聴
先天性難聴は世界中で出生児1000人に1人の割合で発症し、最も多い先天性障害である。その半数以上は遺伝子に原因を持つ遺伝性難聴とされている。遺伝性難聴は難聴以外の症状を伴う症候群性と難聴を主症状とする非症候群性に分類される。
2*:コネキシン26・GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴)
コネキシン26は遺伝子GJB2(GAP JUNCTION PROTEIN, BETA-2)により合成され、内耳のギャップ結合を構成する主要タンパク質の一つ。世界で最も高頻度に検出される遺伝性難聴の原因因子。 GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴)は、我が国では遺伝性難聴の50%以上もの割合を占めるとされており、常染色体劣性と常染色体優性の遺伝形式を持つ感音性難聴。まれに皮膚疾患を伴うものもあるが、主には非症候群性。
3*:ギャップ結合
コネキシンは細胞膜で6個の集合体により分子の通り道を作り、隣の細胞の集合体と連結してギャップ結合を作る。このギャップ結合は分子量約1000以下の低分子やイオンを濃度勾配によって透過させ、細胞間の物質輸送を可能とする。
【原著論文】
タイトル:
「In vitro models of GJB2-related hearing loss recapitulate Ca2+ transients via a gap junction characteristic of developing cochlea」
著者:
Ichiro Fukunaga, Ayumi Fujimoto, Kaori Hatakeyama, Toru Aoki, Atena Nishikawa,
Tetsuo Noda, Osamu Minowa, Nagomi Kurebayashi, Katsuhisa Ikeda, Kazusaku Kamiya
掲載誌: Stem Cell Reports, 2016
DOI: 10.1016/j.stemcr.2016.10.005
本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業(研究開発代表者 神谷和作)、文部科学省科学研究費 基盤研究B(課題番号25293351 )、基盤研究 C (課題番号25462653 )、挑戦的萌芽研究(課題番号16693312 )、若手研究B(課題番号15K20229 )、厚生労働科学研究・障害者対策総合研究事業、私立大学戦略的研究基盤形成支援事業、私立学校振興・共済事業団・学術研究振興資金、テルモ科学技術振興財団、武田科学振興財団などの支援を受け行われました。
・iPS細胞から遺伝性難聴の原因となる内耳ギャップ結合形成細胞の作製法を開発
・Gjb2変異型難聴モデル動物において難聴の分子病態を再現
・遺伝性難聴に対する薬剤スクリーニングや再生医療への応用に期待
【背景】
聴覚障害は出生児1000人に1人の割合で発症し、先天性疾患の中で最も高頻度に発生する疾患の一つです。その半数以上は遺伝子変異を原因とする遺伝性難聴です。中でもGJB2(コネキシン26)変異型難聴は、遺伝性難聴の50%以上もの割合を占めています。コネキシン(CX)26は、内耳の細胞間のイオン輸送を行うギャップ結合の構成要素の一つであり(図1)、内耳リンパ液のイオン組成を保つことにより音の振動を神経活動へ変換する重要な分子ですが、その変異によりギャップ結合の構造が保てず難聴になります。
 【図1】内耳ギャップ結合とコネキシン26、GJB2遺伝子との関係
【図1】内耳ギャップ結合とコネキシン26、GJB2遺伝子との関係
現時点では、本疾患に対する根本的な治療法や治療薬は存在せず、その開発が求められてきました。私たち研究チームは発症メカニズムの解明と遺伝子治療法の開発を行ってきましたが、根本的治療を目指すため、薬剤開発や再生医療を含めた総合的な治療法開発が必要と考えました。この遺伝性難聴の再生医療では、iPS細胞などの多能性幹細胞からCX26ギャップ結合を形成する内耳細胞群(図2)の作製が最も重要です。これまでiPS細胞からいくつかの内耳細胞を作る方法は報告されていますが、遺伝性難聴で最も頻度の高い原因遺伝子、GJB2遺伝子がコードするCX26で作られる巨大ギャップ結合を形成する内耳細胞(図2)を作る技術はありませんでした。
 【図2】本研究のターゲットとなる蝸牛支持細胞等のギャップ結合形成細胞
【図2】本研究のターゲットとなる蝸牛支持細胞等のギャップ結合形成細胞
【内容】
これまで、iPS細胞などの多能性幹細胞から神経などの外胚葉性組織への分化誘導法が多く報告されています。その中に外胚葉性組織を効率よく分化させるSFEBq法(無血清凝集浮遊培養法)という三次元培養法があります。今回、私たち研究グループはSFEBq法を改良し、外胚葉性組織の中で神経組織とは異なる系統にある内耳組織、特に内耳蝸牛においてギャップ結合のネットワークを形成する内耳支持細胞群の作製を試みました。
研究チームはまずiPS細胞を外胚葉に分化させるSFEBq法の過程で、GJB2遺伝子が作るCX26というタンパク質が最も多く発現する三次元培養の条件を選抜しました。特にBMP4とTGFb阻害剤を添加した培養法でCX26発現が顕著に増加しました。この三次元培養には他の細胞も混在するため、コネキシン26ギャップ結合が形成される細胞塊を分離し、独自に開発した蝸牛由来の細胞上で培養しました。この培養法により、内耳同様の巨大なギャップ結合を均一に形成する細胞シートが作製できました(図3)。
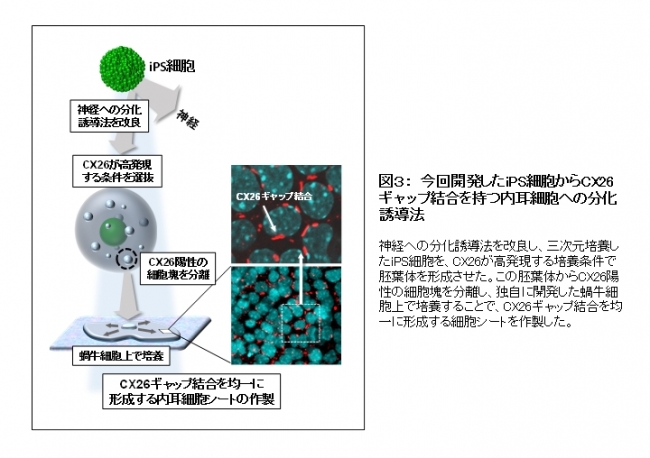 【図3】今回開発したiPS細胞からCX26ギャップ結合を持つ内耳細胞への分化誘導法
【図3】今回開発したiPS細胞からCX26ギャップ結合を持つ内耳細胞への分化誘導法
作製した細胞シートのギャップ結合は内耳と同様に細胞間で物質を輸送する能力を持ち、内耳の発達期にみられる自発的カルシウムシグナル伝搬という特殊な機能を示しました。さらに、疾患モデル細胞としての機能を確認するため、Gjb2遺伝子を欠損させた難聴マウスのiPS細胞から内耳細胞を作ったところ、難聴発症の原因となるギャップ結合複合体が崩壊する様子が再現できました(図4)。
以上の結果から、本研究で開発した分化誘導法は、iPS細胞からGJB2変異型遺伝性難聴の疾患モデル細胞となる内耳ギャップ結合形成細胞を作製する有効な技術となります。
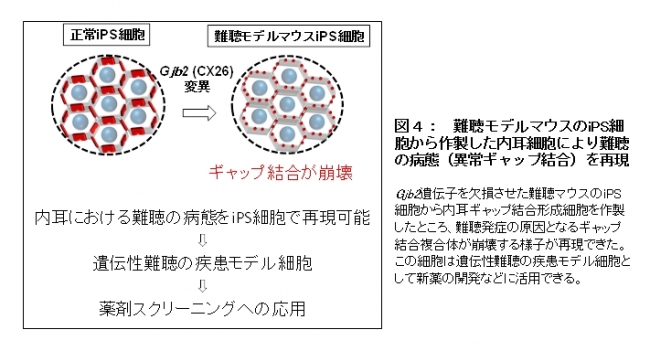 【図4】難聴モデルマウスのiPS細胞から作製した内耳細胞により難聴の病態(異常ギャップ結合)を再現
【図4】難聴モデルマウスのiPS細胞から作製した内耳細胞により難聴の病態(異常ギャップ結合)を再現
【今後の展開】
今回私たちが開発したiPS細胞から内耳ギャップ結合形成細胞を作製する方法は、これまで根本的治療法の存在しなかった遺伝性難聴の再生医療を可能とし、難聴研究の臨床応用を実現させる上での大きな成果であると考えます。さらに、開発した内耳細胞は、GJB2変異型遺伝性難聴の疾患モデル細胞として細胞治療法の開発に活用でき、薬剤スクリーニングや新規薬剤の有効性・安全性評価への応用も可能です。
現在、研究チームはヒトiPS細胞から内耳ギャップ結合形成細胞の作製を行っています。今後はGJB2変異型遺伝性難聴の患者さんのiPS細胞の樹立と分化誘導により、様々な変異型に応じた遺伝性難聴疾患モデル細胞を作製し、薬剤開発や再生医療を含めた総合的な難聴治療法の開発を目指していきます。
【用語説明】
1*:先天性難聴・遺伝性難聴
先天性難聴は世界中で出生児1000人に1人の割合で発症し、最も多い先天性障害である。その半数以上は遺伝子に原因を持つ遺伝性難聴とされている。遺伝性難聴は難聴以外の症状を伴う症候群性と難聴を主症状とする非症候群性に分類される。
2*:コネキシン26・GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴)
コネキシン26は遺伝子GJB2(GAP JUNCTION PROTEIN, BETA-2)により合成され、内耳のギャップ結合を構成する主要タンパク質の一つ。世界で最も高頻度に検出される遺伝性難聴の原因因子。 GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴)は、我が国では遺伝性難聴の50%以上もの割合を占めるとされており、常染色体劣性と常染色体優性の遺伝形式を持つ感音性難聴。まれに皮膚疾患を伴うものもあるが、主には非症候群性。
3*:ギャップ結合
コネキシンは細胞膜で6個の集合体により分子の通り道を作り、隣の細胞の集合体と連結してギャップ結合を作る。このギャップ結合は分子量約1000以下の低分子やイオンを濃度勾配によって透過させ、細胞間の物質輸送を可能とする。
【原著論文】
タイトル:
「In vitro models of GJB2-related hearing loss recapitulate Ca2+ transients via a gap junction characteristic of developing cochlea」
著者:
Ichiro Fukunaga, Ayumi Fujimoto, Kaori Hatakeyama, Toru Aoki, Atena Nishikawa,
Tetsuo Noda, Osamu Minowa, Nagomi Kurebayashi, Katsuhisa Ikeda, Kazusaku Kamiya
掲載誌: Stem Cell Reports, 2016
DOI: 10.1016/j.stemcr.2016.10.005
本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業(研究開発代表者 神谷和作)、文部科学省科学研究費 基盤研究B(課題番号25293351 )、基盤研究 C (課題番号25462653 )、挑戦的萌芽研究(課題番号16693312 )、若手研究B(課題番号15K20229 )、厚生労働科学研究・障害者対策総合研究事業、私立大学戦略的研究基盤形成支援事業、私立学校振興・共済事業団・学術研究振興資金、テルモ科学技術振興財団、武田科学振興財団などの支援を受け行われました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
