【慶應義塾】iPS細胞創薬と医療ビッグデータ が導くALSの新たな治療薬開発
-iPS細胞を用いたテーラーメイド医療実現への大きな一歩-
今回の研究結果により、iPS細胞創薬の有用性が明らかとなり、有効な治療法に乏しいALSという神経難病に、新たな治療の選択肢がもたらされる可能性が示されました。
同グループは2016年に、京都大学の山中伸弥教授が発明したiPS細胞を用いて、パーキンソン病の薬であるロピニロールがALSの病態に有効であることを見出しました。今回の臨床試験により、その薬の安全性と効果がALS患者さんでも確認され、iPS細胞創薬によって、既存薬以上の臨床的疾患進行抑制効果をもたらしうる薬剤の同定に世界で初めて成功し、この度、iPS細胞等幹細胞を用いた研究に関する著明な国際科学雑誌であるCell Stem Cell誌(Cell Press)に、2023年6月2日(日本時間)に掲載されました。
具体的には、ロピニロールを最終的に16mg内服することで、1年間の試験期間で、病気の進行を27.9週間(約7か月)遅らせる可能性があります。この結果は、ALS治験に関する国際患者レジストリデータ(注5)による検証からも支持されました。
また、ロピニロールの効果を判定するためのサロゲートマーカー(注6)の候補も同定しました。このことは、今後の臨床試験を行っていく上でも重要な知見になります。
さらには、患者さんのiPS細胞モデルを用いることで、1人1人の患者さんに対する薬剤の有効性を評価できる可能性を見出し、適切な投薬治療に資するiPS細胞を用いたテーラーメイド医療(注7)の実現に一石を投じることとなりました。
1.研究の背景
ALSは「難病の患者に対する医療等に関する法律」において難病指定を受けている難治性神経疾患の一つで、脊髄運動ニューロン(注 8)の障害による筋萎縮と筋力の低下を特徴とする進行性の病気です。歩行困難、言語障害、嚥下障害および呼吸障害などの症状があり、本人の意識や知覚が正常であるにも関わらず、生活やコミュニケーションの自由が阻害されるため、生活の質(QOL)は著しく低下します。また、経過には個人差があるものの、発症から死亡ないしは呼吸器装着までの期間は20~48か月であると報告されています(日本神経学会:筋萎縮性側索硬化症診療ガイドライン2013)。
これまでの研究から、ALSの原因としては、発症後に生じる神経突起の短縮、ミトコンドリア機能障害、異常タンパク質凝集、酸化ストレスの亢進、神経興奮毒性、神経炎症、アポトーシス(神経細胞死)の亢進といった一連の異常が推測されています。また、ALSの実験モデル(注 9)として家族性ALSの原因遺伝子を導入した変異マウスなどが多く用いられてきましたが、実際のヒト脊髄における病態を十分に再現したモデルは未だ存在しません。
そこで、慶應義塾大学医学部生理学教室では、2016年にヒトiPS細胞を用いたヒト脊髄運動ニューロンの作製および革新的な治療薬の探索を目的とした実験手法を開発しました。これらを用いて、健常者およびALS患者さん由来の血液細胞から作ったiPS細胞を分化誘導することで脊髄運動ニューロンを作製し、既に薬として米国で使用されている1,232種類の化合物の中からALS病態の改善が期待できる候補化合物を選び出しました(薬剤スクリーニング)。脳内移行性や副作用を含む安全性などを考慮した上で、ロピニロール塩酸塩(ロピニロール)という既にパーキンソン病治療薬として承認・販売されている薬剤をALS治療候補薬として同定しました。今回の臨床試験では、家族性ALSの患者のみならず、ALSの大多数を占める孤発性(注 10)ALS患者さんのうち約70%にも効果がある可能性が示されました。
上記の結果から、ROPALS試験として、トランスレーショナルリサーチ(ALS患者さんに対するロピニロールの安全性と有効性を確かめるための、iPS細胞創薬(注 11)に基づいた医師主導治験:臨床研究)ならびにリバース・トランスレーショナルリサーチ(生体試料や治験参加患者iPS細胞を用いたサロゲートマーカーや治療メカニズムの探索:基礎研究)、という2つの試験を並行して実施しました(図1)。
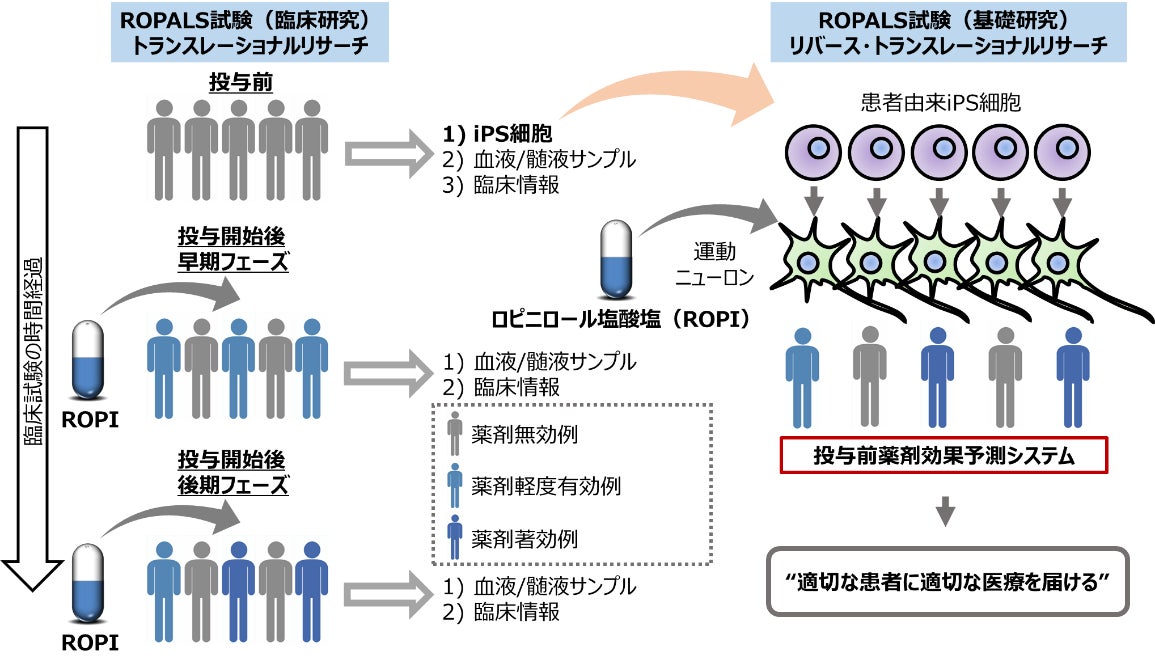
図1.臨床研究と基礎研究が一体となったROPALS試験
2.研究の成果と意義・今後の展開
ROPALS試験(医師主導治験:トランスレーショナルリサーチ)
29例のALS患者が臨床試験に登録され、最終的に13名の患者にロピニロール、7名の患者にプラセボ(注 12)の内服投与が行われました。すべての患者さんが、最大用量(16mg)を内服することができ、有害事象(注 13)による内服中止はありませんでした。したがって、ALS患者に対するロピニロールの安全性と忍容性(注 14)が確認されました。
また、最初の6か月間はロピニロールとプラセボをそれぞれのグループで内服し、その後の6か月間は患者全員がロピニロールを内服しました。ALSに対する薬の効果については、12か月の全試験期間を対象とした場合、ALS症状の重さを表す一般的な指標であるALSFRS-Rスコア(48点満点)(注 15)において、二重盲検期(最初の6ヶ月)ロピニロール投与群(ロピニロール群)では5.9±4.1ポイントの低下に対し、二重盲検期プラセボ投与群(プラセボ群)では15.6±8.8ポイントの低下となり、より大きな機能低下を認めました。
従来のALSの治験では、前述のALSFRS-Rスコアという症状の評価が有効性をみる標準的指標として用いられてきました。しかしながら、ALSFRS-Rスコアは患者の症状を詳細かつ均質に評価できるとは言い難いものでした。そこで本治験では、ALSで主に障害される筋力や活動量を定量的に測定し、数値化することによって、薬の効果を正確に評価する方法を導入しました。また、ALSFRS-Rスコアを異なる側面から評価するCAFSスコア(注 16)や、活動量(注 17)という項目を採用しました。その結果、ロピニロール群では、最初の6ヶ月の間に、複数の筋肉における筋力低下や活動量の低下が有意に抑制されることがわかりました。また、CAFSスコアについても、全試験期間を対象とした場合、ロピニロール群において、有意に良好な結果を示しました。さらに、呼吸状態が悪くなるまでの期間(%FVC≦50%に至るまでの期間:注 18)についても、ロピニロール群で有意に延長されました。
特筆すべきことに、死亡または一定の病気の進行までの期間を生存期間として検討した結果、生存期間の中央値は,ロピニロール群50.3(95%CI下限:8.4)週,プラセボ群22.4(95%CI下限:4.3)週でした。これは、計1年の試験期間中に、プラセボ群と比較してロピニロール群において、病気の進行を27.9週間(約7か月)遅らせる可能性があることがわかりました(p=0.008)。
上記の結果については、医師主導治験終了後の2021年5月20日にプレスリリースを行いました。
タイトル:神経難病における iPS 細胞創薬に基づいた医師主導治験を完了-筋萎縮性側索硬化症(ALS)治療の世界に新たな扉を開く-
URL:https://www.keio.ac.jp/ja/press-releases/2021/5/20/28-80089/
今回さらに、国際的医療ビッグデータである大規模なALS患者レジストリデータベース(Pooled Resource Open-Access ALS Clinical Trials; PRO-ACT)を活用し、ALS患者に対するロピニロールの有効性についての頑健性が確認されました。
ROPALS試験(基礎研究:リバース・トランスレーショナルリサーチ)
さらに本治験では、治験参加患者から血液や髄液といった体液を経時的に採取し分析したところ、ロピニロールの薬効指標あるいは病気の進行指標として、髄液中ニューロフィラメント軽鎖(NfL)濃度あるいは過酸化脂質濃度がサロゲートマーカーとして有用な可能性を見出しました。(図2)
特筆すべききことに、医師主導治験と並行して、被験者20例全員からiPS細胞を樹立、ALSの標的である脊髄運動ニューロンを作製し、ロピニロールの効果を調べました。すると、患者さんの運動ニューロンは脆弱性を示し、ロピニロール処置により病態の改善を認めました。驚くべきことに、iPS細胞由来運動ニューロンにおいてロピニロールの効果が高かった患者さんでは、臨床試験での効果がより高いことが臨床研究データとの相関から明らかとなり、iPS細胞が薬剤効果を予測するマーカーとなり得る可能性が示唆されました。
さらにはロピニロールが、神経細胞内のコレステロール合成(SREBP2依存性コレステロール生合成経路)を制御することによって抗ALS作用を発揮していることを見出しました。(図2)

図2.ROPALS試験結果の概要(論文図解要旨)
以上から、ALS患者に対するロピニロールの安全性ならびに効果が示され、世界で初めてALSに対するiPS細胞創薬の臨床でのProof-of-Concept (POC)(注 19)を取得しました。これらの研究結果を以って一日でも早く、この難病中の難病に苦しまれているALS患者さんに新たな治療選択肢を届けられるよう、本研究グループは貢献して参ります。
3.特記事項
本治験実施までに行った研究は、国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)「神経疾患特異的iPS細胞を活用した病態解明と新規治療法の創出を目指した研究」および橋渡し研究加速ネットワークプログラム、橋渡し研究支援拠点(慶應義塾大学)の支援によって行われました。
また、本治験の実施においては、AMED難治性疾患実用化研究事業「iPS細胞創薬に基づいた新規筋萎縮性側索硬化症(ALS)治療薬であるロピニロール塩酸塩の実用化第1/2a相試験」、株式会社ケイファーマ(https://kpharma.co.jp/)(注 20)からの資金支援、ならびにグラクソ・スミスクライン株式会社から治験薬の提供を受け、慶應義塾大学病院で実施しました。
さらに、本治験のリバース・トランスレーショナル研究においては、AMED難治性疾患実用化研究事業「疾患特異的iPS細胞創薬に基づいた筋萎縮性側索硬化症(ALS)治験における薬剤応答性評価技術の開発」、「筋萎縮性側索硬化症克服のためのDeep-Phenotyping の統合解析を通じた治療開発研究」、再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞の利活用促進・難病研究加速プログラム)「神経疾患特異的iPS細胞を活用した病態解明と新規治療法の創出を目指した研究」、精神・神経疾患メカニズム解明プロジェクト(双方向トランスレーショナル研究を基軸にする疾患横断的な精神・神経疾患研究)「孤発性筋萎縮性側索硬化症の双方向トランスレーショナル研究による病態介入標的の同定と核酸医薬の開発研究」、JSPS科研費JP16H06277、JP22K15736、JP21H05273、JP22K07500、JP20H00485、公益財団法人 上原記念生命科学財団、公益財団法人 岡三加藤文化振興財団、公益信託宮田幸比古記念ALS研究助成基金、一般社団法人日本ALS協会 小出良夫基金研究奨励金、の支援によって行われました。
本研究内容と関連する特許として「筋萎縮性側索硬化症治療剤及び治療用組成物」がすでに特許出願されています。
4.論文
英文タイトル:Phase 1/2a clinical trial in ALS with ropinirole, a drug candidate identified by iPSC drug discovery
タイトル和訳:iPS細胞創薬で同定した薬剤候補「ropinirole」のALSを対象とした第1/2a相臨床試験
著者名:森本悟(筆頭著者)、髙橋愼一(共筆頭著者)、伊東大介、伊達悠岳、岡田健佑、加藤玖里純、中村志穂、小澤史子、Chai Muh Chyi、西山亜由美、鈴木直輝、藤森康希、近藤統翔、髙尾昌樹、平井美和、加部泰明、末松誠、陣崎雅弘、青木正志、藤木勇人、佐藤泰憲、鈴木則宏、中原仁、The Pooled Resource Open-Access ALS Clinical Trials Consortium、岡野栄之(責任著者)
掲載誌:Cell Stem Cell
DOI: 10.1016/j.stem.2023.04.017
【用語解説】
(注1)ロピニロール塩酸塩(ロピニロール):ドーパミンという体を動かす指令に関わる
信号を刺激する物質で、脳内でドーパミンが不足するパーキンソン病という病気の
治療薬として、世界で広く使用されている。
(注2)医師主導治験:通常は、製薬会社が中心となって患者への薬の試験を行う。しかし、
大学等で開発された薬の効果を確かめる場合、医師が中心となって、試験の計画か
ら実施までを行うことがある。このような試験を、企業治験と区別し、医師主導治
験と呼ぶ。
(注3)トランスレーショナルリサーチ(Translational research):基礎医学研究の成果を臨床医学に応用することを目的とした研究手法。基礎医学研究で得られた知見を、疾患の発症・進展・治療法の開発に役立てることが重要な目的。
(注4)リバース・トランスレーショナルリサーチ(Reverse translational research):臨床医学現場で得られた情報や知見をもとに、疾患の原因や病態生理を解明し、その知見をもとに新しい治療法を開発するための研究手法。具体的には、患者から得られた臨床的なデータや生体試料を基に、疾患のメカニズムを解明することや、新しい治療法の開発につながる情報を得ることが期待されている。
(注5)患者レジストリデータ:臨床現場で得られる様々な情報を集めた医療ビッグデータのこと。
(注6)サロゲートマーカー:臨床試験において、治療効果の指標を代替するバイオマーカーで、その変化が治療効果と強く相関するとされている。サロゲートマーカーは測定が容易で、病気の進行状況や治療効果を早期に評価できるため、臨床試験において有用な指標となっている。
(注7)個人の体質や病気の状態を把握した上で、その人に確実に効果のある投薬や治療を行うこと。類義語に、個別化医療(パーソナライズド・メディシン)、精密医療(プレシジョン・メディシン)、オーダーメイド医療、などがある。
(注8)脊髄運動ニューロン:身体の筋肉を動かすための神経細胞。
(注9)実験モデル:薬の効果を確認するために、ヒトと同じ病気にさせた動物や細胞。
(注10)孤発性:患者は散発的に生じ、複数の遺伝因子・環境因子が関与している病気という意味で用いられる。多くの神経変性疾患において、大部分の患者が孤発性だが、対して家族内で見られる場合を家族性と呼ぶ。
(注11)iPS細胞創薬:2007年に京都大学の山中伸弥教授が発明した、体のどんな細胞にもなれるiPS細胞を、病気の原因となる体の細胞に変化させて(分化)、薬の評価を行う全く新しいスタイルの薬剤開発方法。
(注12)プラセボ:ロピニロール塩酸塩の錠剤と見た目の区別はつかないが、ロピニロール塩酸塩の有効成分が含まれていないもの。
(注13)有害事象:医薬品の使用によって生じたあらゆる好ましくない反応。
(注14)忍容性:副作用が被験者にとってどれだけ耐え得るかの程度を示したもの。
(注15)ALSFRS‒R(ALS Functional Rating Scale-Revised)スコア:代表的なALS 患者機能評価スケールであり、多くの治験や臨床研究における評価指標として使用されており、日常生活活動度の変化を反映している。
(注16)CAFSスコア:ALSFRS-Rスコアと死亡イベントを併せて評価し、被験者間でランクをつけて評価する新たな治験評価スケール。
(注17)活動量:オムロン社の3次元加速度センサー搭載活動量計(Active style Pro HJA-750C)を患者につけてもらい、身体活動データを10秒ごとに記録し、歩行や生活活動を定量的に測定したもの。
(注 18)%FVC≦50%:呼吸の状態を表す指標で、呼吸機能が正常の50%以下になる状態を示したもの。
(注 19)臨床POC(Proof of Concept):一般に、医学における文脈では、POCとは、新しい医療技術、治療法、医薬品、装置などが、その概念やアイデアが実用的かつ効果的であることを示すための初期の実証実験や研究を指します。本研究の場合は、ある薬剤が疾患の治療薬になり得るという仮説(コンセプト)を設定し、その薬剤が患者に対して実際に治療効果を示すことを、適切な指標を用いて直接的(場合によっては間接的)に実証すること。
(注 20)株式会社ケイファーマ:慶應義塾大学医学部発ベンチャー企業で、2016年11月に創業。ヒトiPS細胞技術を活用し、脊髄損傷や脳梗塞等の再生医療事業、および神経難病等を対象としたiPS創薬(疾患特異的iPS細胞を活用した創薬)事業をおこなっている。また、世界中のアンメット・メディカル・ニーズを少しでも解消すべく、再生医療事業、iPS創薬事業を通じて、医療分野での社会貢献を進めている。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
