発熱がウイルス性肺炎の重症化を抑制するメカニズムを解明
――重症化の抑制には38℃以上の体温で活性化した腸内細菌叢が必要だった――
◆体温が38℃以上になるとインフルエンザウイルスや新型コロナウイルス(SARS-CoV-2)に対する抵抗力が上がることを世界で初めて明らかにした。
◆体温の上昇により活性化した腸内細菌叢は、体内の二次胆汁酸レベルを増加させて、ウイルスの増殖およびウイルス感染による炎症反応を抑えていることが分かった。
◆二次胆汁酸は新型コロナウイルス感染症(COVID-19)の重症度を予測しうるバイオマーカーになることが分かった。また胆汁酸受容体を標的にすることによりウイルス性肺炎の重症化を抑える新しい治療薬の開発などに繋がることが期待される。
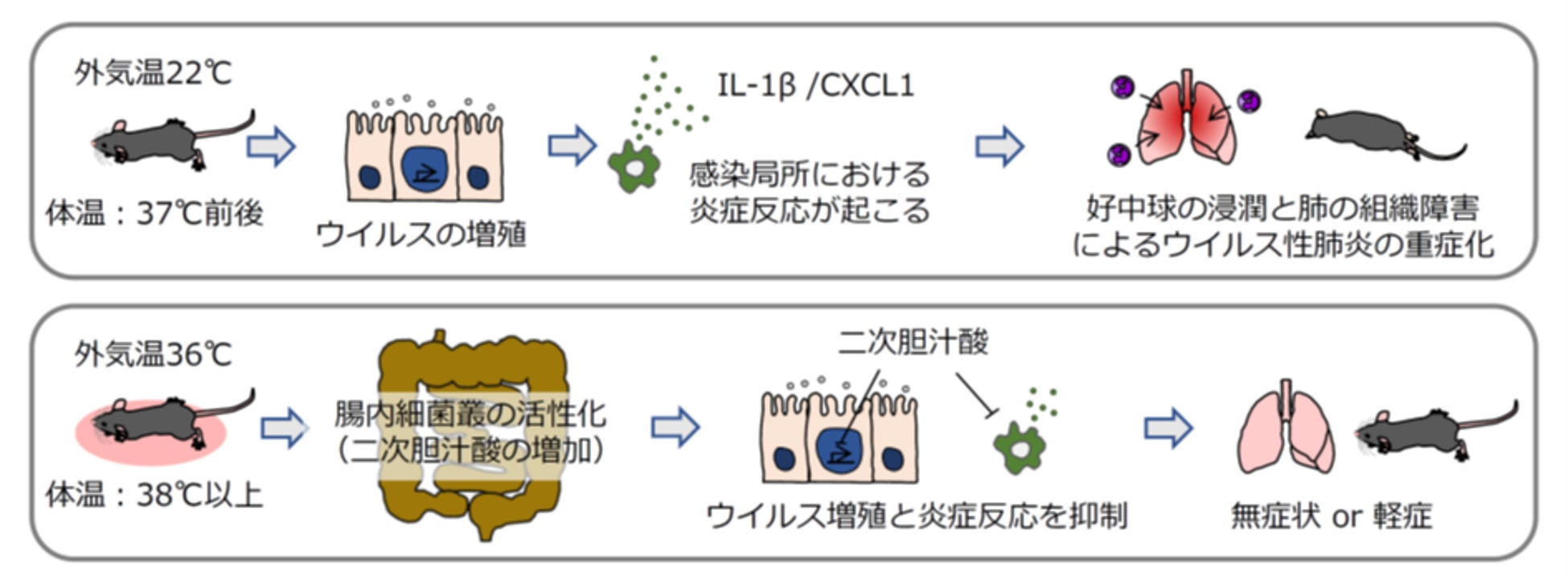 発熱がウイルス性肺炎の重症化を抑制するメカニズム
発熱がウイルス性肺炎の重症化を抑制するメカニズム
発表概要
東京大学医科学研究所の一戸猛志准教授と、慶應義塾大学先端生命科学研究所の福田真嗣特任教授、順天堂大学大学院医学研究科総合診療科学の内藤俊夫教授らによる研究グループは、38℃以上に上昇した体温(発熱)が腸内細菌叢の活性化を介して二次胆汁酸量を増加させ、ウイルス性肺炎の重症化を抑制することを分子レベルで明らかにすることに成功しました。
これまで外気温や体温がウイルスに感染した場合の重症度に与える影響についてはほとんど分かっていませんでした。外気温や体温がウイルス感染後の重症度に与える影響を解析するため、さまざまな温度条件で飼育したマウスにインフルエンザウイルスを感染させた場合の重症度を解析しました。すると36℃条件下で飼育したマウスでは体温が38℃を超えるようになり、インフルエンザウイルスのみならずSARS-CoV-2の感染に対しても高い抵抗力を獲得することが分かりました。
22℃で飼育したマウス(体温は37℃前後)と36℃条件下で飼育して体温が38℃を越えたマウスの血清と盲腸内容物のメタボローム解析を行ったところ、体温が38℃を越えたマウスの体内では胆汁酸レベルが有意に増加しており、特に盲腸内容物中では二次胆汁酸量が有意に増加していることを見出しました。
また22℃で飼育したマウスやハムスターにデオキシコール酸(DCA)やウルソデオキシコール酸(UDCA)などの二次胆汁酸を与えると、インフルエンザウイルスやSARS-CoV-2感染後の生存率が有意に改善することを明らかにしました。
さらにCOVID-19患者から採取した血液サンプルを解析したところ、胆汁酸レベルが軽症患者グループと比較して中等症Ⅰ/Ⅱ患者グループで有意に低下していることが明らかとなりました。このことはヒトにおいてもCOVID-19の重症度と胆汁酸レベルに逆相関関係があることを示しています。
本研究成果は、体温が38℃以上に上昇することにより腸内細菌叢が活性化し、二次胆汁酸産生を介してウイルス感染後の重症化予防に役立っていることを分子レベルで明らかにした世界初の成果であり、高齢者がインフルエンザやCOVID-19で重症化しやすくなるメカニズムの解明や、宿主とウイルスの共生メカニズムの解明、胆汁酸受容体を標的としたウイルス性肺炎の重症化を抑える新しい治療薬の開発などに繋がることが期待されます。本研究成果は2023年6月30日、英国科学雑誌「Nature Communications」オンライン版に掲載されました。
発表内容
これまで外気温や体温がウイルス感染後の重症度に与える影響について詳細に解析された例はありませんでした。東京では夏に気温が36℃に達することもある一方、1月の平均最低気温は約4℃まで低下します。またインフルエンザや新型コロナウイルス感染症(COVID-19)の死亡率は、高齢者で高くなることが知られています。高齢者は筋力の低下などが原因で基礎体温が低下することから、研究グループは外気温や体温に着目し、それらがインフルエンザウイルスやSARS-CoV-2に対する抵抗力に与える影響について解析しました。
外気温や体温がインフルエンザウイルス感染後の重症度に与える影響を解析するため、マウスを4℃、22℃、36℃条件下で7日間飼育しました。すると22℃飼育マウスと比較して4℃飼育グループではマウスの基礎体温が有意に低下することが分かりました(図1a)。逆に36℃条件下で飼育した場合、マウスの基礎体温は38℃を越えるようになることも分かりました(図1a)。
このマウスにインフルエンザウイルスを経鼻的に感染させ、ウイルス感染後も各温度条件下で飼育したところ、22℃飼育グループと比較して、4℃飼育グループではウイルス感染後に重症化した一方、36℃飼育マウスでは致死的なウイルス感染に対して抵抗力を獲得していることが分かりました(図1b)。同様に36℃飼育マウスでは致死的なSARS-CoV-2感染に対して抵抗力を獲得していることが分かりました(図1c)。

図1:外気温がマウスの基礎体温やインフルエンザウイルス感染後の重症度に与える影響
(a)マウスを各温度条件下で飼育して、ウイルスを感染させる前のマウスの基礎体温を測定した。〇印はそれぞれのマウスの値を表す。(b,c)各温度条件で飼育したマウスにインフルエンザウイルス(b)またはSARS-CoV-2(c)を感染させ、感染14日後までの生存率を観察した。
36℃条件下で飼育したマウスの体温が38℃を越えるようになるとウイルス感染に対する抵抗力が高くなる理由として、発熱により温められた体内の腸内細菌叢が活性化しているのではないかと考えました。
この仮説を検証するため、通常のエサと水道水を与えたコントロールグループ、低食物繊維食と水道水を与えた低食物繊維食グループ、通常のエサと抗生物質を混ぜた水道水を与えた抗生物質グループに分け、このマウスを36℃条件下で飼育したあと、インフルエンザウイルスを経鼻的に感染させました。するとどのグループもウイルス感染前後の体温は38℃以上に保たれていたものの(図2a)、低食物繊維食グループや抗生物質グループはインフルエンザウイルス感染に対する抵抗力が失われていることが分かりました(図2b)。
このことから、インフルエンザウイルス感染に対する抵抗力の獲得には38℃以上の体温そのものではなく、発熱により温められた際の腸内細菌叢の活性化が重要であることが示唆されました。
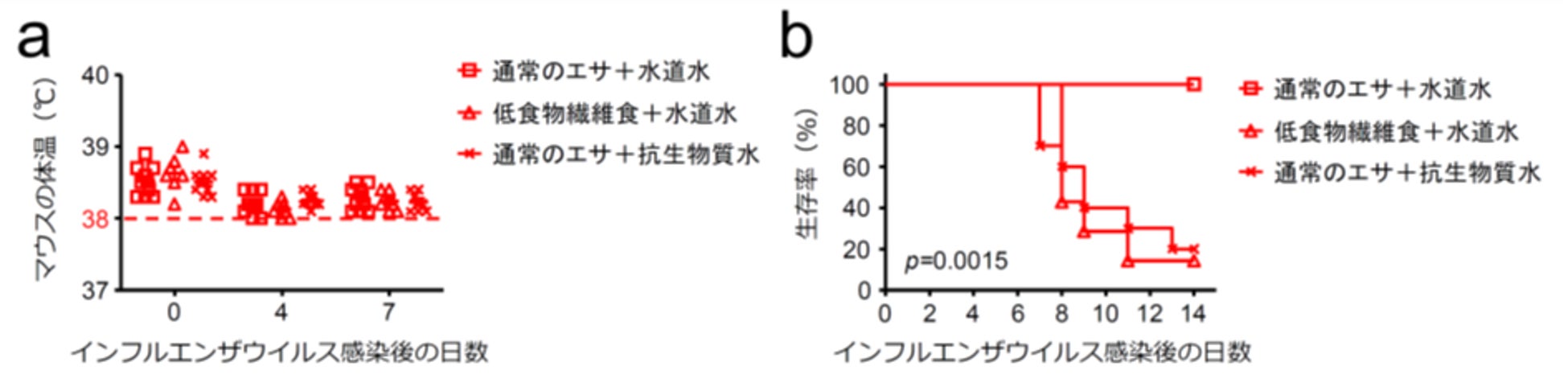
図2:体温が上昇した場合のウイルス感染に対する抵抗力には腸内細菌叢由来代謝物質が重要である
(a,b) 36℃条件下で飼育したマウスに通常のエサまたは低食物繊維食、飲み水として水道水または抗生物質水を与えた。インフルエンザウイルスを感染させ、感染14日後までのマウスの体温(a)および生存率(b)を観察した。
次にウイルス感染に対する抵抗力が高くなる36℃飼育マウスの体内で何が起こっているのかを解析するため、4℃、22℃、36℃で7日間飼育したマウスの血清サンプルを用いてメタボローム解析を行いました。すると一次胆汁酸(注1)であるコール酸や二次胆汁酸であるデオキシコール酸、ウルソデオキシコール酸の濃度が36℃飼育マウスの血中で有意に高くなっていることが分かりました(図3)。
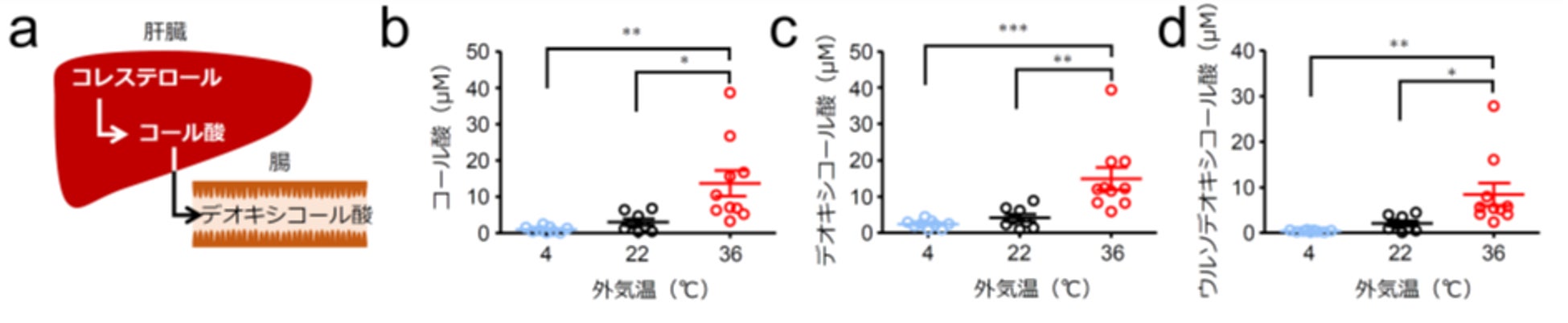
図3:36℃飼育マウスにおける血中胆汁酸レベルの増加
(a)デオキシコール酸の合成経路。コレステロールを材料に肝臓で一次胆汁酸(コール酸など)が合成される。一次胆汁酸が腸へ分泌されると腸内細菌の働きにより二次胆汁酸(デオキシコール酸など)へ変換される。(b,c) 4℃、22℃、36℃条件下で7日間飼育したマウスの血清のメタボローム解析を行った。(b)コール酸濃度。(c)デオキシコール酸濃度。(d)ウルソデオキシコール酸濃度。〇印はそれぞれのマウスの値を表す。
次に22℃飼育条件下のマウスに通常の水道水またはデオキシコール酸(DCA)やウルソデオキシコール酸(UDCA)を混ぜた水道水を与え、インフルエンザウイルスを経鼻的に感染させました。するとDCAやUDCAを与えたグループでは、肺のウイルス量や好中球(注2)の数が減少し(図4a,b)、インフルエンザウイルス感染後の生存率が有意に改善することが分かりました(図4c,d)。
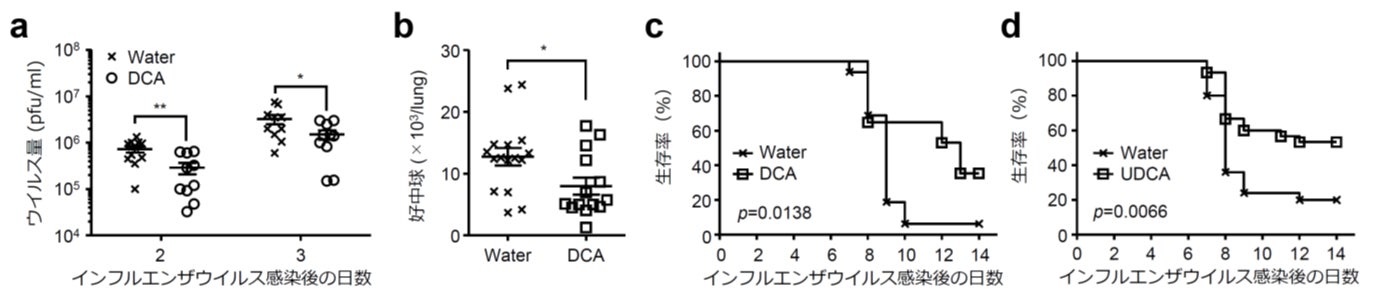
図4:デオキシコール酸によるインフルエンザ重症化抑制効果
22℃飼育条件下のマウスに通常の水道水または0.5mMのデオキシコール酸(DCA)(a-c)またはウルソデオキシコール酸(UDCA)(d)を混ぜた水道水を与え、インフルエンザウイルスを経鼻的に感染させた。(a)ウイルス感染2日目と3日目の肺のインフルエンザウイルスの量を示す。(b)ウイルス感染7日目の肺に浸潤した好中球の数を示す。(c,d)ウイルス感染14日目までのマウスの生存率。
次に胆汁酸受容体であるTGR5のアゴニストであるHY-14229がインフルエンザウイルスの増殖や炎症反応を抑制する効果を示すのかを調べるため、培養細胞やマクロファージにインフルエンザウイルスを感染させ、HY-14229存在下で24時間培養しました。するとHY-14229存在下では、インフルエンザウイルスの増殖やウイルス感染により誘導されるIL-1β(注3)の産生が抑えられていることが分かりました(図5)。
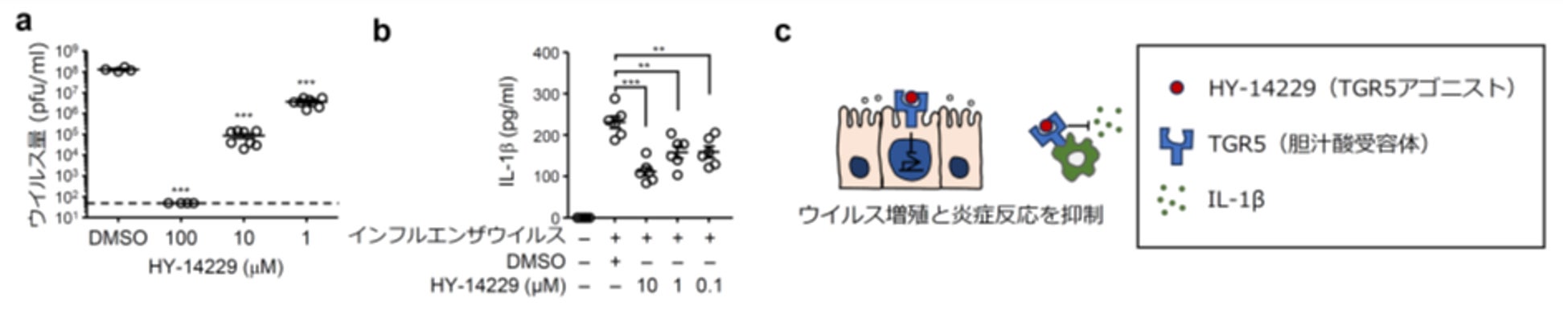
図5:胆汁酸受容体アゴニストによるインフルエンザウイルスの増殖抑制効果
(a)MDCK細胞にインフルエンザウイルスを感染させ、TGR5アゴニスト(HY-14229)存在下で24時間培養した。24時間後の培養上清中のウイルス量をプラークアッセイ法で測定した。(b)マウス骨髄マクロファージにインフルエンザウイルスを感染させ、TGR5アゴニスト(HY-14229)存在下で24時間培養した。24時間後の培養上清中のIL-1β量をELISAで測定した。(c)TGR5アゴニスト(HY-14229)はインフルエンザウイルスの増殖およびウイルス感染により誘導される炎症反応を抑制していると考えられた。
最後にCOVID-19患者の重症度と血漿中の胆汁酸レベルに相関があるかどうかを解析しました。COVID-19患者を軽症、中等症Ⅰ/Ⅱのグループに分けると、確かに血漿中の重症化マーカーであるフィブリノーゲン(注4)が中等症Ⅰ/Ⅱグループで有意に高くなっていることが分かり(図6a)、逆に胆汁酸の一種であるグリシン抱合型コール酸(GCA)が中等症Ⅰ/Ⅱグループで有意に低くなっていることが明らかとなりました(図6b)。
このことはヒトにおいてもCOVID-19の重症度と胆汁酸レベルに逆相関関係があることを示しています。そこで22℃飼育条件下のハムスターに通常の水道水またはGCAまたはDCAを混ぜた水道水を与え、SARS-CoV-2を経鼻的に感染させるとGCAやDCAを与えたグループでは、SARS-CoV-2感染後の生存率が有意に改善することが分かりました(図6c,d)

図6:COVID-19の重症度と胆汁酸濃度
(a,b) COVID-19患者の血漿中のフィブリノーゲン濃度(a)とGCA濃度(b)。(c,d) 22℃飼育条件下のシリアンハムスターに通常の水道水または0.5mMのGCAまたはDCAを混ぜた水道水を与え、SARS-CoV-2を経鼻的に感染させた。ウイルス感染から14日目までの生存率を観察した。
これらの知見を活かして、今後は高齢者がインフルエンザやCOVID-19で重症化しやすくなるメカニズムの解明や、宿主とウイルスの共生メカニズムの解明、胆汁酸受容体を標的としたウイルス性肺炎の重症化を抑える新しい治療薬の開発に向けた研究を推進する予定です。
発表者
東京大学医科学研究所 感染症国際研究センター ウイルス学分野
一戸 猛志(准教授)
長井 みなみ <研究当時:大学院生>
森山 美優 <研究当時:大学院生>
慶應義塾大学先端生命科学研究所
福田 真嗣(特任教授)
石井 千晴(研究員)
平山 明由(准教授)
石川 貴正(インフィニティ・ラボ株式会社 代表取締役)
順天堂大学大学院医学研究科
内藤 俊夫(総合診療科学 教授)
永原 章仁(消化器内科学 教授)
石川 大(消化器内科学 准教授)
森 博威(総合診療科学准教授)
メタジェンセラピューティクス株式会社
中原 拓(代表取締役社長CEO)
渡邊 日佳流(研究員)
京都大学
木村 郁夫(教授)
東京工業大学
山田 拓司(准教授)
論文情報
〈雑誌〉Nature Communications
〈題名〉High body temperature increases gut microbiota-dependent host resistance to influenza A virus and SARS-CoV-2 infection
〈著者〉Minami Nagai#, Miyu Moriyama#, Chiharu Ishii#, Hirotake Mori, Hikaru Watanabe, Taku Nakahara, Takuji Yamada, Dai Ishikawa, Takamasa Ishikawa, Akiyoshi Hirayama, Ikuo Kimura, Akihito Nagahara, Toshio Naito*, Shinji Fukuda*, Takeshi Ichinohe*
#Equal contribution; *Corresponding author
〈DOI〉10.1038/s41467-023-39569-0
〈URL〉https://www.nature.com/articles/s41467-023-39569-0
研究助成
本研究は、一戸猛志准教授に対するワクチン開発のための世界トップレベル研究開発拠点の形成事業(JP223fa627001)、MSD生命科学財団、武田科学振興財団、鈴木謙三記念医科学応用研究財団、および福田真嗣特任教授に対する日本学術振興会科学研究費助成事業(22H03541)、科学技術振興機構戦略的創造研究推進事業(JST ERATO)深津共生進化機構プロジェクト(JPMJER1902)、日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)(JP22gm1010009)、糧食研究会などの支援の下で実施されました。
用語解説
(注1)胆汁酸
胆汁酸には界面活性作用があり、腸で脂肪をミセル化して脂肪の吸収を促進している。腸へ分泌された一次胆汁酸は腸内細菌の働きにより二次胆汁酸へ変換される。
(注2)好中球
ウイルス感染などにより炎症が起こると、その炎症を目印に好中球が感染局所に集まってくる。好中球はウイルスや細菌などの病原体を見つけて貪食することにより病原体の排除に役立っている。また好中球は自身の二本鎖DNAにタンパク質分解酵素を絡ませた網状の構造からなる好中球細胞外トラップ(NETs: neutrophil extracellular traps)を細胞外に放出することにより病原体を補足・殺菌しているが、これが過剰な炎症反応を引き起こすことにより肺などの組織にダメージを与えてしまう場合がある。
(注3)IL-1β
ウイルス感染局所の炎症反応に関わるサイトカイン。IL-1βは好中球の遊走因子であるCXCL1を誘導して感染局所に好中球をリクルートすると同時に好中球にも作用して好中球細胞外トラップ(NETs: neutrophil extracellular traps)を誘導することも知られている。この NETs は肺組織障害や重症 COVID-19 患者でしばしばみられる血栓の原因のひとつとして考えられている。
(注4)フィブリノーゲン
血液凝固因子のひとつで、出血を止める働きがある。ウイルス感染などにより体内に炎症が生じると血中のフィブリノーゲンが増加する。COVID-19重症患者では血中のフィブリノーゲン値が高くなることが知られているため、COVID-19の重症化マーカーとして用いられている。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
