パーキンソン病の病態を表す鍵となる分子をヒトで検出
~リン酸化ユビキチン鎖がパーキンソン病に関与することが明らかに~
順天堂大学大学院医学研究科・神経学の服部信孝教授、パーキンソン病病態解明研究講座の今居譲先任准教授らの研究グループは、若年性遺伝性パーキンソン病の2つの原因遺伝子であるPINK1(ピンクワン)とParkin(パーキン)*1 が協働して作るリン酸化ユビキチンの鎖が、パーキンソン病患者iPS細胞由来のドーパミン神経*2 細胞と患者脳において異常な挙動を示すことを明らかにしました。リン酸化ユビキチン鎖は、細胞内で損傷ミトコンドリア*3 のオートファジー*4 による除去のために作られますが、パーキンソン病患者のドーパミン細胞内では、この仕組みがうまく働いていないことを本研究で初めて立証しました。この成果により、パーキンソン病の効果的な予防・治療法の開発が進むと期待されます。本研究は英国科学誌Human Molecular Geneticsに早期公開版として、2017年5月25日付けで発表されました。
【本研究成果のポイント】
【背景】
PINK1遺伝子とParkin遺伝子は、若年発症をするパーキンソン病の原因遺伝子で、機能が低下したミトコンドリアを除去する働きがあることが明らかとなっています。しかし、これらの遺伝子に傷がつき正常に機能しない場合、損傷ミトコンドリアが蓄積し、パーキンソン病になると考えられています。通常、損傷ミトコンドリアが生じるとPINK1とParkinがそれを感知し除去しますが、そのメカニズムには、第一にParkinがユビキチンを損傷ミトコンドリアに繋げること、第二にPINK1がそのユビキチンにリン酸を付加(リン酸化)することが必要なことを、2014年に私たちはヒト培養細胞とパーキンソン病モデル動物(ショウジョウバエ)で明らかにしました(図1)*5。そこで本研究は、実際のパーキンソン病患者の神経細胞において、このメカニズムの病態モデルを実証することを目的に行いました。
【内容】
ミトコンドリアは、細胞に必要なエネルギーの産生、脂質や鉄の代謝、細胞内カルシウム濃度の調節などを担う細胞小器官です。ミトコンドリアは細胞になくてはならない重要な細胞小器官ですが、エネルギーを産生するときに活性酸素が発生し、頻繁に調子が悪くなると考えられています。PINK1はリン酸をタンパク質に付加(リン酸化)する酵素(キナーゼ)で、調子の悪くなったミトコンドリア(損傷ミトコンドリア)を監視する役割を持ちます。損傷ミトコンドリアが発生すると、PINK1はParkinが繋いだユビキチンの鎖にリン酸を付加することで損傷ミトコンドリアを除去します(図1)。私たちが非神経系培養細胞の実験で明らかにしたこのメカニズムでは、PINK1とParkin が連携して作るリン酸化ユビキチン鎖が鍵となります。パーキンソン病で特に変性する中脳黒質のドーパミン神経で、リン酸化ユビキチン鎖が検出されれば、損傷ミトコンドリアの蓄積がパーキンソン病で起こっている証拠になると考えました。そこで、パーキンソン病患者脳(図2)と、患者由来iPS細胞から作製したドーパミン神経(図3)を用いて、リン酸化ユビキチン鎖の状態を調べました。
その結果、予想通りリン酸化ユビキチン鎖のシグナルが、パーキンソン病で変化していることが分かりました。さらに重要なことに、ドーパミン神経では、他の神経に較べて、リン酸化ユビキチン鎖のシグナルが強いことを発見しました(図4)。このことは、PINK1やParkinが特にドーパミン神経で忙しく働いていることを示しており、PINK1やParkinの働きがドーパミン神経の生存に特に重要であることを意味します。またこの結果はPINK1やParkinに変異があると、若くしてドーパミン神経が変性しパーキンソン病になるという臨床での観察と一致しています。
今回のリン酸化ユビキチン鎖の検出結果を図5にまとめます。この成果から、パーキンソン病研究ではドーパミン神経を対象とした研究が特に重要であると言えます。
【今後の展開】
PINK1遺伝子やParkin遺伝子の変異が引き金となる若年性パーキンソン病は、概ね40歳までに発症します。一方、大部分のパーキンソン病は、遺伝的要因が不明で比較的高齢で発症し、孤発性パーキンソン病と呼ばれます。今回の研究では、一部の孤発性パーキンソン病脳でリン酸化ユビキチン鎖が観察されました。このことから、孤発性パーキンソン病でも損傷ミトコンドリアが増えている場合があると予想できます。今後は、損傷ミトコンドリアを除去する実行因子であるParkinのスイッチを操作する人工的な方法を開発し、損傷ミトコンドリアの除去によるパーキンソン病の効果的な早期予防に向けて、さらなる研究を進める予定です。
【用語解説】
*1 PINK1、Parkin: PINK1遺伝子、Parkin遺伝子から作られるタンパク質は、それぞれ同名のPINK1、Parkinと名付けられている。ここでは便宜上、遺伝子は「PINK1遺伝子」、タンパク質は「PINK1」と表記する。
*2 ドーパミン神経: パーキンソン病において神経変性が起こる神経。この神経が変性するとパーキンソン病で見られる運動機能障害(手足の震え、筋肉の硬直、姿勢制御の障害など)が起こる。
*3 ミトコンドリア: 細胞の活動に必要なエネルギー(ATP)を作る細胞小器官。損傷ミトコンドリアとは、損傷をうけて機能が低下した状態のミトコンドリアを示す。この器官の損傷や老化が進むと、酸化ストレスの原因となる活性酸素種が器官内部から漏洩する。
*4 オートファジー、マイトファジー: オートファジーは細胞内の不要なものを除去する細胞の反応。損傷ミトコンドリアもオートファジーで除去されるが、ミトコンドリアを対象としたオートファジーをマイトファジーと呼ぶ。
*5 「パーキンソン病の2つの原因遺伝子が神経保護をする仕組みを解明 ~不良ミトコンドリアを効率よく除去するメカニズムが明らかに~」 にて2014年12月5日 順天堂大学よりプレス発表。
発表誌:Human Molecular Genetics
タイトル:Evidence that phosphorylated ubiquitin signaling is involved in the etiology of Parkinson’s disease
日本語訳:リン酸化ユビキチンシグナルがパーキンソン病の発症に関与する証拠
著者名 : Kahori Shiba-Fukushima, Kei-ichi Ishikawa, Tsuyoshi Inoshita, Nana Izawa, Masashi Takanashi,Shigeto Sato, Osamu Onodera, Wado Akamatsu, Hideyuki Okano, Yuzuru Imai, Nobutaka Hattori
DOI: https://doi.org/10.1093/hmg/ddx201
謝辞: なお、本研究はJSPS科研費 JP26461280, JP16K19524, JP26293070, JP15H04842、MEXT科研費 JP26117727, JP23111003 、中冨健康科学振興財団、日本応用酵素協会および大塚製薬の研究助成を受け、慶應義塾大学 岡野栄之先生、本学ゲノム再生医療センター 赤松和土先生、新潟大学脳研究所 小野寺理先生 らの協力のもと、柴-福嶋佳保里助教、石川景一助教、井下強助教が中心となり実施しました。また、本研究に協力頂きました患者さんのご厚意に深謝いたします。
- 若年性パーキンソン病の原因遺伝子PINK1とParkinがつくるリン酸化ユビキチン鎖は、パーキンソン病患者では健常者とは異なる挙動を示す
- 不良ミトコンドリアを取り除くためのリン酸化ユビキチン鎖の形成は、他の神経に比べてドーパミン神経で著しく観察された
- 実際にパーキンソン病患者ドーパミン神経細胞では、不良ミトコンドリアを取り除く能力が低下していた
【背景】
PINK1遺伝子とParkin遺伝子は、若年発症をするパーキンソン病の原因遺伝子で、機能が低下したミトコンドリアを除去する働きがあることが明らかとなっています。しかし、これらの遺伝子に傷がつき正常に機能しない場合、損傷ミトコンドリアが蓄積し、パーキンソン病になると考えられています。通常、損傷ミトコンドリアが生じるとPINK1とParkinがそれを感知し除去しますが、そのメカニズムには、第一にParkinがユビキチンを損傷ミトコンドリアに繋げること、第二にPINK1がそのユビキチンにリン酸を付加(リン酸化)することが必要なことを、2014年に私たちはヒト培養細胞とパーキンソン病モデル動物(ショウジョウバエ)で明らかにしました(図1)*5。そこで本研究は、実際のパーキンソン病患者の神経細胞において、このメカニズムの病態モデルを実証することを目的に行いました。
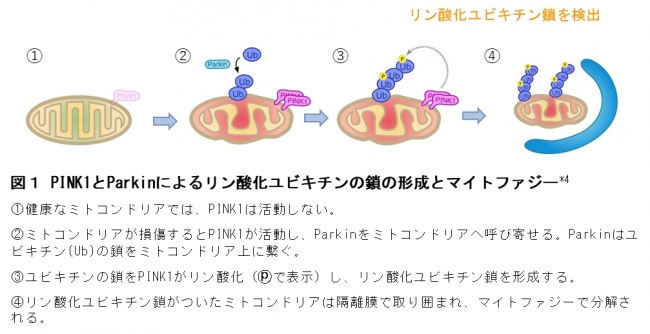 図1 PINK1とParkinによるリン酸化ユビキチンの鎖の形成とマイトファジー
図1 PINK1とParkinによるリン酸化ユビキチンの鎖の形成とマイトファジー
【内容】
ミトコンドリアは、細胞に必要なエネルギーの産生、脂質や鉄の代謝、細胞内カルシウム濃度の調節などを担う細胞小器官です。ミトコンドリアは細胞になくてはならない重要な細胞小器官ですが、エネルギーを産生するときに活性酸素が発生し、頻繁に調子が悪くなると考えられています。PINK1はリン酸をタンパク質に付加(リン酸化)する酵素(キナーゼ)で、調子の悪くなったミトコンドリア(損傷ミトコンドリア)を監視する役割を持ちます。損傷ミトコンドリアが発生すると、PINK1はParkinが繋いだユビキチンの鎖にリン酸を付加することで損傷ミトコンドリアを除去します(図1)。私たちが非神経系培養細胞の実験で明らかにしたこのメカニズムでは、PINK1とParkin が連携して作るリン酸化ユビキチン鎖が鍵となります。パーキンソン病で特に変性する中脳黒質のドーパミン神経で、リン酸化ユビキチン鎖が検出されれば、損傷ミトコンドリアの蓄積がパーキンソン病で起こっている証拠になると考えました。そこで、パーキンソン病患者脳(図2)と、患者由来iPS細胞から作製したドーパミン神経(図3)を用いて、リン酸化ユビキチン鎖の状態を調べました。
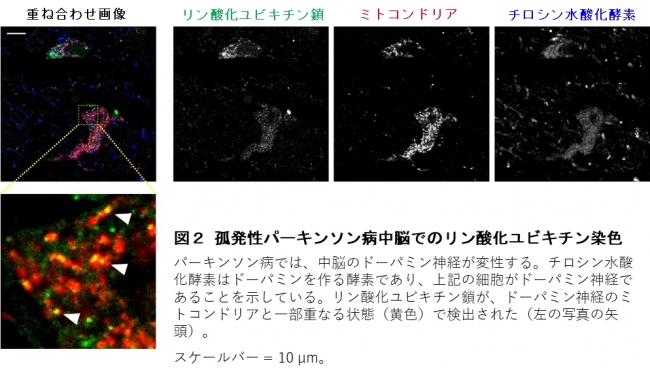 図2 孤発性パーキンソン病中脳でのリン酸化ユビキチン染色
図2 孤発性パーキンソン病中脳でのリン酸化ユビキチン染色
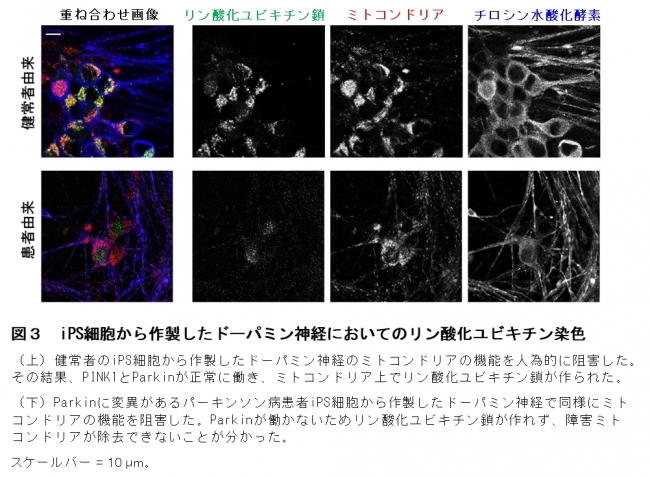 図3 iPS細胞から作製したドーパミン神経においてのリン酸化ユビキチン染色
図3 iPS細胞から作製したドーパミン神経においてのリン酸化ユビキチン染色
その結果、予想通りリン酸化ユビキチン鎖のシグナルが、パーキンソン病で変化していることが分かりました。さらに重要なことに、ドーパミン神経では、他の神経に較べて、リン酸化ユビキチン鎖のシグナルが強いことを発見しました(図4)。このことは、PINK1やParkinが特にドーパミン神経で忙しく働いていることを示しており、PINK1やParkinの働きがドーパミン神経の生存に特に重要であることを意味します。またこの結果はPINK1やParkinに変異があると、若くしてドーパミン神経が変性しパーキンソン病になるという臨床での観察と一致しています。
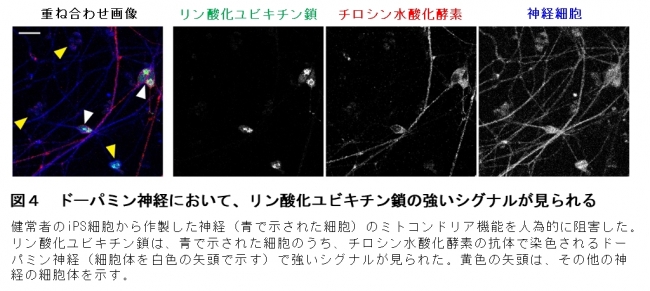 図4 ドーパミン神経において、リン酸化ユビキチン鎖の強いシグナルが見られる
図4 ドーパミン神経において、リン酸化ユビキチン鎖の強いシグナルが見られる
今回のリン酸化ユビキチン鎖の検出結果を図5にまとめます。この成果から、パーキンソン病研究ではドーパミン神経を対象とした研究が特に重要であると言えます。
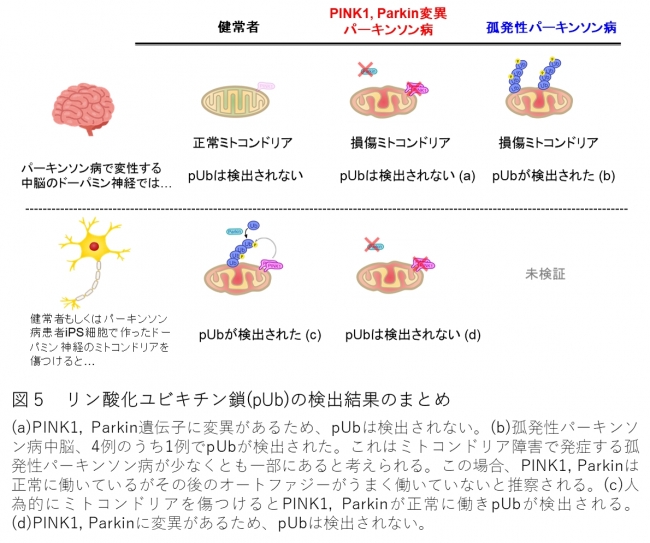 図5 リン酸化ユビキチン鎖(pUb)の検出結果のまとめ
図5 リン酸化ユビキチン鎖(pUb)の検出結果のまとめ
【今後の展開】
PINK1遺伝子やParkin遺伝子の変異が引き金となる若年性パーキンソン病は、概ね40歳までに発症します。一方、大部分のパーキンソン病は、遺伝的要因が不明で比較的高齢で発症し、孤発性パーキンソン病と呼ばれます。今回の研究では、一部の孤発性パーキンソン病脳でリン酸化ユビキチン鎖が観察されました。このことから、孤発性パーキンソン病でも損傷ミトコンドリアが増えている場合があると予想できます。今後は、損傷ミトコンドリアを除去する実行因子であるParkinのスイッチを操作する人工的な方法を開発し、損傷ミトコンドリアの除去によるパーキンソン病の効果的な早期予防に向けて、さらなる研究を進める予定です。
【用語解説】
*1 PINK1、Parkin: PINK1遺伝子、Parkin遺伝子から作られるタンパク質は、それぞれ同名のPINK1、Parkinと名付けられている。ここでは便宜上、遺伝子は「PINK1遺伝子」、タンパク質は「PINK1」と表記する。
*2 ドーパミン神経: パーキンソン病において神経変性が起こる神経。この神経が変性するとパーキンソン病で見られる運動機能障害(手足の震え、筋肉の硬直、姿勢制御の障害など)が起こる。
*3 ミトコンドリア: 細胞の活動に必要なエネルギー(ATP)を作る細胞小器官。損傷ミトコンドリアとは、損傷をうけて機能が低下した状態のミトコンドリアを示す。この器官の損傷や老化が進むと、酸化ストレスの原因となる活性酸素種が器官内部から漏洩する。
*4 オートファジー、マイトファジー: オートファジーは細胞内の不要なものを除去する細胞の反応。損傷ミトコンドリアもオートファジーで除去されるが、ミトコンドリアを対象としたオートファジーをマイトファジーと呼ぶ。
*5 「パーキンソン病の2つの原因遺伝子が神経保護をする仕組みを解明 ~不良ミトコンドリアを効率よく除去するメカニズムが明らかに~」 にて2014年12月5日 順天堂大学よりプレス発表。
発表誌:Human Molecular Genetics
タイトル:Evidence that phosphorylated ubiquitin signaling is involved in the etiology of Parkinson’s disease
日本語訳:リン酸化ユビキチンシグナルがパーキンソン病の発症に関与する証拠
著者名 : Kahori Shiba-Fukushima, Kei-ichi Ishikawa, Tsuyoshi Inoshita, Nana Izawa, Masashi Takanashi,Shigeto Sato, Osamu Onodera, Wado Akamatsu, Hideyuki Okano, Yuzuru Imai, Nobutaka Hattori
DOI: https://doi.org/10.1093/hmg/ddx201
謝辞: なお、本研究はJSPS科研費 JP26461280, JP16K19524, JP26293070, JP15H04842、MEXT科研費 JP26117727, JP23111003 、中冨健康科学振興財団、日本応用酵素協会および大塚製薬の研究助成を受け、慶應義塾大学 岡野栄之先生、本学ゲノム再生医療センター 赤松和土先生、新潟大学脳研究所 小野寺理先生 らの協力のもと、柴-福嶋佳保里助教、石川景一助教、井下強助教が中心となり実施しました。また、本研究に協力頂きました患者さんのご厚意に深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
