ギリアド・サイエンシズ、米国肝臓学会議(AASLD The Liver Meeting® 2017)にて、日本人患者におけるC型肝炎治療の新たな臨床データを発表
ハーボニー配合錠のジェノタイプ2型の患者に対するリバビリン・フリー療法の、適応追加申請及びSOF/VEL配合剤の、DAA治療不成功のジェノタイプ1及び2型のC型慢性肝治療薬の申請をサポートするデータ
ギリアド・サイエンシズ株式会社は、C 型慢性肝炎治療薬「ハーボニー®配合錠」が、ジェノタイプ2型のC型慢性肝炎患者に用いられる可能性を示すデータを発表します。また、現時点では救済療法が存在しない、直接作用型抗ウイルス剤(DAA)治療不成功のジェノタイプ1または2型のC型慢性肝炎患者を対象に、Sofosbuvir/Velpatasvir配合剤(SOF/VEL)を評価した試験の結果も発表されます。いずれの試験でも、治療法が限定されているこれらのC型慢性肝炎患者において、95~97%という高い治癒率が示されました。詳細な試験結果は、米国肝臓病学会(AASLD)が、本日よりワシントンDCにて開催する米国肝臓学会議(The Liver Meeting® 2017)にて発表されます。
2017年10月20日
<報道関係各位>
ギリアド・サイエンシズ株式会社
ギリアド・サイエンシズ
米国肝臓学会議(AASLD The Liver Meeting® 2017)にて
日本人患者におけるC型肝炎治療の新たな臨床データを発表
ハーボニー®配合錠のジェノタイプ2型の患者に対するリバビリン・フリー療法の
適応追加申請及びSofosbuvir/Velpatasvir配合剤の
直接作用型抗ウイルス剤(DAA)治療不成功のジェノタイプ1型及び2型の
C型慢性肝治療薬の申請をサポートするデータ
ギリアド・サイエンシズ株式会社(以下「ギリアド」)(本社:東京都千代田区、 代表取締役社長:折原祐治)は、C 型慢性肝炎治療薬「ハーボニー®配合錠」(以下「ハーボニー」)(レジパスビル90 mg/ソホスブビル400mg配合錠)が、ジェノタイプ2型のC型慢性肝炎患者に用いられる可能性を示すデータを発表します。また、現時点では救済療法が存在しない、直接作用型抗ウイルス剤(DAA)治療不成功のジェノタイプ1または2型のC型慢性肝炎患者を対象に、Sofosbuvir/Velpatasvir配合剤(SOF/VEL)を評価した試験の結果も発表されます。いずれの試験でも、治療法が限定されているこれらのC型慢性肝炎患者において、95~97%という高い治癒率が示されました。詳細な試験結果は、米国肝臓病学会(AASLD:American Association for the Study of Liver Diseases)が、本日よりワシントンDCにて開催する米国肝臓学会議(The Liver Meeting® 2017)にて発表されます。
日本国内のC型慢性肝炎患者の約30%を占めるジェノタイプ2型の日本人C型慢性肝炎患者を対象とした第III相試験では、ハーボニーを1日1回1錠、12週間投与した結果、患者の治療歴や肝硬変の有無に関係なく、96%がSVR12(治療終了後12週時点でウイルス量が検出限界未満)を達成しました。本試験結果は、10月21日のポスターセッションにて発表されます(ポスター番号: 1184)。
上記試験に加え、DAA治療不成功のジェノタイプ1または2型のC型慢性肝炎の日本人患者を対象とした第III相試験では、24週間のSOF/VELとリバビリン(RBV)の併用療法の結果、患者の97%がSVR12を達成しました。本試験結果は、10月23日の口演にて発表されます(口演番号: 194)。
ギリアド研究開発部門のエグゼクティブ・バイス・プレジデント兼 CSO(Chief Scientific Officer)であるノーバート・ビショフバーガー(Norbert Bischofberger)博士は、次のように述べています。「ギリアドはC型慢性肝炎の患者さんの転帰改善に継続的に取り組み、安全かつ簡便で、効果の高い治療薬により、C型慢性肝炎を治癒する機会をすべての患者さんに提供すべく努力しています。これらの試験より、他の薬剤で治療できない、または既存の治療法が使えない患者さんの治療に、SOF/VELやハーボニーが有効であることを示す、幅広い実臨床エビデンスが構築されました。今回のデータは、日本での承認申請の資料となり、承認が得られれば、現在の治療法で治癒が困難であった患者さんに、新たな治療の選択肢を提供することができます」。
ハーボニー®配合錠【ジェノタイプ2型のC型慢性肝炎】
本試験は実薬対象を用いた第III相非盲検試験で、ジェノタイプ2型のC型慢性肝炎または代償性肝硬変の患者239例が参加しました。患者は、ハーボニー投与群(n=106)またはソバルディ®(ソホスブビル400 mg)の1日1回投与とRBV(600~1,000mgを分割投与)を併用する群(n=108)のいずれかに無作為に割り付けられ、12週間の投与を受けました。第2コホートとして、RBVに不耐容又は不適格な患者のグループ(n=25)がハーボニーの1日1回、12週間の投与を受けました。
第1コホートでは、ハーボニー群の96%(102/106)、ソバルディ®とRBVの併用群では95%(103/108)の患者がSVR12を達成しました。第2コホートのRBV不耐容/不適群では96%(24/25)の患者がSVR12を達成しました。本試験結果は、ソバルディ®とRBV併用に対するハーボニーの非劣性を示し、主要評価項目を達成しました。
主な有害事象(>5%)は、鼻咽頭炎、頭痛及び貧血でした。貧血は、ソバルディ®とRBVの併用群でのみで認められました。試験責任医師が治験薬との因果関係ありとした重篤な有害事象の発現はなく、治療期間中の死亡例もありませんでした。ハーボニー群の1例とソバルディ®とリバビリン併用群の2例は、有害事象のため投薬を早期に中止しました。有害事象発現率は、ハーボニー群の方がソバルディ®とRBV併用群より低い値でした。
東京医科歯科大学消化器内科 肝臓病態制御学講座の朝比奈靖浩教授は、次のように述べています。「本日発表されるデータは、C型慢性肝炎の患者さん、特に日本のC型慢性肝炎患者の20-30%を占めるジェノタイプ2型の患者さんにとって大きな前進となります。今回の試験結果は、リバビリンが使えず、治癒を得る選択肢がほとんどなかった患者さんにとって、ハーボニーが重要な治療選択肢となる可能性を示す内容です」
ハーボニーは、日本では「セログループ1(ジェノタイプ1)のC型慢性肝炎又はC型代償性肝硬変におけるウイルス血症の改善」を適応症として承認されています。
SOF/VEL【ジェノタイプ1型及び2型のDAA治療不成功例】
本試験は第III相非盲検試験で、NS5A阻害剤を含むDAA製剤を4週間以上投与されたジェノタイプ1型のC型慢性肝炎患者95例と、DAA製剤を4週間以上投与されたジェノタイプ2型のC型慢性肝炎患者22例が参加しました。患者は、SOF/VEL(400mg/100mg)と RBVの併用療法を12週間行う群(n=57)と24週間行う群(n=60)のいずれかに1:1の比で無作為に割り付けられました。 各群のSVR12は以下の通りです。
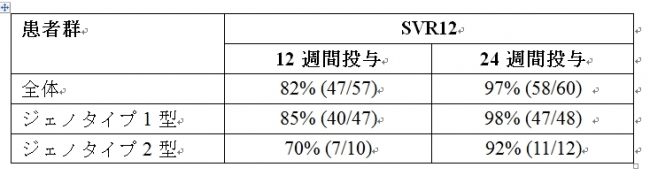
SOF/VEL+RBVによる治療を24週間受けた代償性肝硬変患者は全例とも、SVR12を達成しました。ベースライン時点で1種類以上のNS5A耐性変異のHCVウイルスが認められた患者は多かったものの、治療成績に影響はなく、再燃例にも本治療に伴う新たな耐性変異の発現を認めませんでした。
SOF/VELによる再治療の忍容性は良好でした。12週投与群及び24週投与群ともに、主な有害事象(>10%)は、ウイルス性上気道感染、貧血及び頭痛でした。治験薬との因果関係が否定できない重篤な有害事象は認められませんでした。
試験結果を発表する武蔵野赤十字病院院長 泉並木医師は、次のように述べています。「直接作用型抗ウイルス剤の登場により、C型肝炎ウイルス感染に伴う疾病負担が下がりましたが、治療が奏功せず、複雑な耐性ウイルスが発現した患者さんの再治療の選択肢はなく、登場が待たれていました。今回の試験結果は、忍容性の高い24週間の治療法による再治療で、この困難な臨床シナリオにおいて高い治癒率が得られることを立証しました」
日本においては、SOF/VELは開発段階にあり、その安全性と有効性は明らかにされていません。
ハーボニー®配合錠について
ハーボニー®配合錠は、HCV RNA複製を直接阻害する核酸型NS5Bポリメラーゼ阻害剤ソホスブビルとNS5A阻害剤レジパスビルの配合剤であり、C型慢性肝炎ジェノタイプ1型の治療においてインターフェロンを必要とせず、12 週間、1 日 1 回 1 錠の経口投与による初めての治療薬で、本邦においては2015年7月に製造販売承認を取得しました。
ソバルディ®錠について
ソバルディ®は、ジェノタイプ 2 型のC 型慢性肝炎または C 型代償性肝硬変におけるウイルス血症の改善の効果・効能をもつ核酸型 NS5B ポリメラーゼ阻害剤です。C 型慢性肝炎 ジェノタイプ2型の治療においてインターフェロンを必要とせず、RBVとの併用において 12 週間投与を可能とした初めての経口薬のみの治療法で、2015年3月26日に製造販売承認を取得しています。
ギリアド・サイエンシズについて
ギリアド・サイエンシズは、医療ニーズがまだ十分に満たされない分野において、革新的な治療を創出、開発、製品化するバイオファーマ企業です。会社の使命は、生命を脅かす難病を抱える世界中の患者さんのために医療を向上させることです。 カリフォルニア州フォスターシティに本社を置き、世界30か国以上で事業を行っています。
将来予想に関する記述
本プレスリリースは、1995年米国民事証券訴訟改革法(Private Securities Litigation Reform Act of 1995)で定義される「将来予測に関する記述」に該当し、医師がHCV感染症患者の治療にハーボニーを処方しても有益性が認められない場合があるなどの、いくつかのリスクや不確定要素などの要因を含む場合があります。これには、日本において、医薬品医療機器総合機構が、SOF/VELを現在予想されているスケジュール通り承認をしない場合やまったく承認しない場合もあり、たとえ承認されたとしてもそれに対して多大な制約が設けられる可能性もあります。これらのリスクや不確定要素、その他の要因により、実際の結果が「将来予想に関する記述」と著しく異なったものとなる可能性があります。本記述の内容は確定したものではありませんのでご注意ください。
これらのリスクやその他のリスクについては、米国証券取引委員会に提出している、2017 年 6月 30 日までの四半期のギリアド社四半期報告書(フォーム10-Q)で詳細に説明しています。 すべての「将来予想に関する記述」は、現在ギリアドが把握している情報に基づくものであり、ギリアドはそうした「将来予想に関する記述」を更新する義務を負わないものとします。
###
ハーボニー®配合錠およびソバルディ®錠は、ギリアド・サイエンシズ社または同社の関連会社の登録商標です。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像