高精細リン酸化シグナル解析により胃がんの治療標的を同定
治療の経過に伴う胃がんの悪性化の実態も明らかに
国立研究開発法人医薬基盤・健康・栄養研究所(大阪府茨木市、理事長:中村祐輔、以下「NIBIOHN」という。) 創薬デザイン研究センター創薬標的プロテオミクスプロジェクトの足立淳副センター長のグループは、国立がん研究センター中央病院朴成和消化管内科長(研究当時)、庄司広和医長のグループ、日本医科大学大学院医学研究科本田一文教授、NIBIOHN AI健康・医薬研究センター水口賢司客員研究員のグループ、京都大学大学院医学研究科小濱和貴教授のグループと共同で、胃がんの新たな治療法開発に資する発見をしました。詳細は以下のとおりです。
【研究成果のポイント】
-
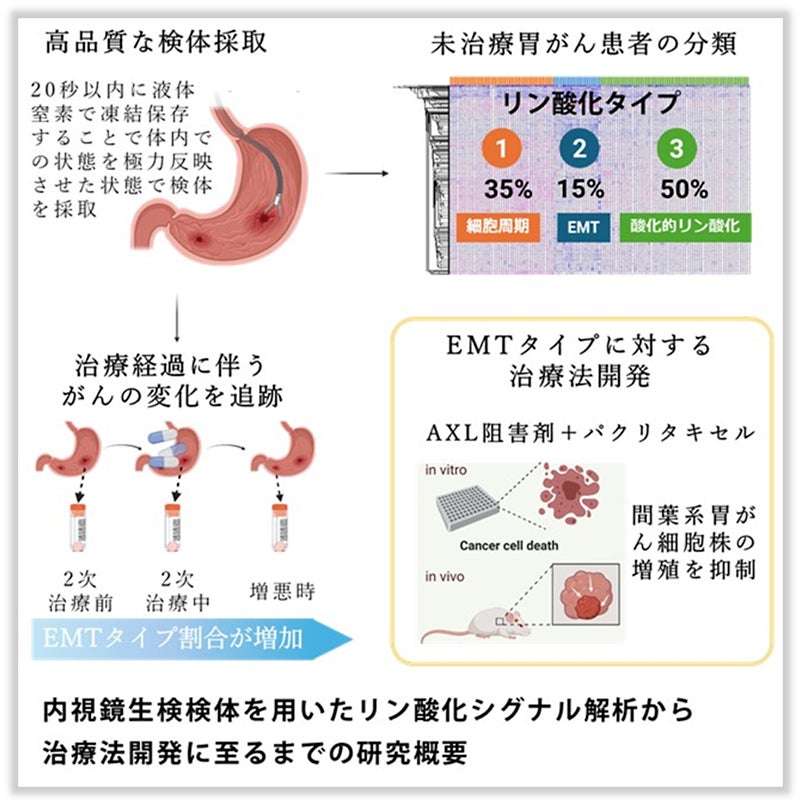
採取した直後に凍結した微量の内視鏡生検検体から、2万個を超えるリン酸化部位を測定し、患者さん毎のリン酸化シグナルの特性を明らかにする技術を開発しました。
-
内視鏡生検検体(127個)のリン酸化シグナルデータに基づいて、未治療の胃がん患者さんは ①細胞周期を制御するキナーゼ群が活性化しているタイプ ②上皮間葉転換(EMT)タイプ ③酸化的リン酸化亢進タイプに分類されました。
-
1次治療での化学療法後(2次治療前)から2次治療中、増悪時と治療が経過するほどEMTタイプの割合が増えることを見出しました。
-
EMTタイプに対する治療法として、EMTタイプで活性化している受容体型チロシンキナーゼAXLの阻害剤と標準治療で使用されているパクリタキセルの併用治療が抗腫瘍効果を有することを胃がん細胞株及びマウス実験で確かめました。
本発見を踏まえて、今後、難治性の胃がんに対する新たな治療法の開発が期待されます。
本研究成果は2024年10月1日(アメリカ時間)に「Cell Reports」に発表されます。
ウェブサイト:https://doi.org/10.1016/j.celrep.2024.114774
研究の背景と意義
胃がんの罹患数及び死亡数は肺がん、大腸がんに次いで3番目に多く、特に切除不能進行胃がんは生存期間中央値がおよそ12ヶ月と予後が非常に悪いため、胃がんに対する新たな治療法の開発が強く求められています。しかし、進行胃がんに有効な分子標的薬は限られており、またゲノムプロファイリングを用いた「がん精密医療」は、具体的な治療に結びつく割合が低いのが現状です。これらの課題を解決するためには、より多くのがん患者さんに対応することができる次世代型「がん精密医療」の実現が重要です。
抗がん剤として用いる分子標的治療薬の多くはタンパク質に直接作用するため、がん細胞内のタンパク質全体(プロテオーム)の情報が、治療法の選択に有用であると期待されています。特にタンパク質のリン酸化修飾を介したリン酸化シグナルはがん細胞のさまざまな機能を制御し、リン酸化シグナルを標的とした抗がん剤も多数開発されていることから、リン酸化シグナル解析の「がん精密医療」への応用が期待されています。
我々のグループは、これまでに、内視鏡検査で採取した直後に凍結した微量の生検検体からリン酸化シグナルを解析する技術を開発し(2019年プレスリリース)、分子標的治療薬トラスツズマブの投与前後に採取した生検検体から患者間で治療応答性の違いが見られることを報告しています(2022年プレスリリース)。
(2019年プレスリリース : https://www.nibiohn.go.jp/information/nibio/2019/12/006180.html)
(2022年プレスリリース : https://www.nibiohn.go.jp/information/nibio/2022/03/007885.html)
本研究の内容
本研究では、これまでの生検検体を用いたリン酸化シグナル解析手法を改良し、未治療胃がん患者さん127検体のリン酸化シグナル解析を行いました。その結果、1検体あたり平均21,103個のリン酸化部位を定量することに成功しました。
リン酸化シグナル情報から、未治療胃がん患者さんの35%はサブタイプ1(細胞周期を制御するキナーゼ群が活性化しているタイプ)、 15%はサブタイプ2(上皮間葉転換(EMT) タイプ)、50%はサブタイプ3(酸化的リン酸化亢進タイプ)に分類されました。
次に、切除不能進行胃がん患者さん9名から1次治療での化学療法後(2次治療前)、2次治療中、増悪時に内視鏡生検検体を採取し、リン酸化シグナル解析を行いました。その結果、サブタイプ2(EMTタイプ)の患者さんが1次治療での化学療法後(2次治療前)、2次治療中、増悪時と治療が経過するほど割合が増えるのに対して、未治療患者さんで多かったサブタイプ1、3の患者さんは、2次治療中、増悪時には存在が認められませんでした。EMTタイプを構成する間葉系がん細胞は、化学療法・分子標的療法・免疫療法に耐性があり、転移を起こしやすいので予後不良であることが知られています。つまり、治療効果が十分に得られずにさらなる治療を経るにつれて、がんが薬剤の効きにくい悪性度の高い性質に変化していることが示唆されました。そこでEMTタイプの胃がんに対する治療法として、EMTタイプで活性化している「受容体型チロシンキナーゼAXL」に着目しました。
まず、胃がん培養細胞の培養時に2種類のAXL阻害剤(ONO-7475、Gilteritinib)をそれぞれパクリタキセルに上乗せして増殖抑制作用を検討すると、AXL活性が高い間葉系胃がん培養細胞でのみAXL阻害剤の上乗せ効果が確認され、上皮系細胞及び中間タイプの細胞ではAXL阻害剤の上乗せ効果はほとんど確認されませんでした。
また間葉系胃がん培養細胞を移植して腫瘍を形成したマウスを用いた実験では、AXL阻害剤(Gilteritinib)とパクリタキセルの併用により腫瘍の増殖が抑制されました。
結論として、内視鏡生検検体を用いたリン酸化シグナル解析は、がんのタイプを分類するだけでなく、治療によるダイナミックながんの変化を捉えられることが分かりました。特に、治療前・治療中の経時的な解析は、個々の患者さんの薬剤によるがんの変化を追跡するために使用することができ、標的となるチロシンキナーゼの同定も可能となる等、「がん精密医療」を実行していく上で、その重要性が示唆されました。
研究支援
本研究成果は、国立研究開発法人日本医療研究開発機構(AMED)革新的がん医療実用化研究事業における研究課題「リン酸化プロテオゲノミクスを基盤としたオンデマンドパスウェイミクス解析による胃癌最適医療の構築」(19ck0106465)及び創薬基盤推進研究事業における研究課題「間葉系胃がんに対する精密医療開発」(23ak0101203)、日本学術振興会 科学研究費補助金(20K17069、20H03544)の支援を受けました。
論文情報
論文タイトル:Phosphoproteomic subtyping of gastric cancer reveals dynamic transformation with chemotherapy and guides targeted cancer treatment.
著者:Hirokazu Shoji*, Hidekazu Hirano, Yosui Nojima, Daigo Gunji, Akina Shinkura, Satoshi Muraoka, Yuichi Abe, Ryohei Narumi, Chioko Nagao, Masahiko Aoki, Kazutaka Obama, Kazufumi Honda, Kenji Mizuguchi, Takeshi Tomonaga, Yutaka Saito, Takaki Yoshikawa, Ken Kato, Narikazu Boku*, and Jun Adachi*
(* 責任著者)
掲載雑誌:Cell Reports
用語解説
1 生検検体
病気の診断を行うために、特殊な針や内視鏡を用いて臓器組織の一部を採取したもの。
2 リン酸化シグナル
細胞内外の刺激に対して細胞膜上・細胞質中のタンパク質が、リン酸化反応を介して、情報伝達を行うこと。がん細胞の増殖、転移、細胞死等に重要な役割を果たしている。
3 上皮間葉転換(Epithelial-Mesenchymal Transition、EMT)
上皮細胞(皮膚や内臓等の表面を覆う細胞)が特定の刺激や環境条件の影響を受けて、その性質が変化し、間葉系細胞(結合組織を形成する細胞)へと転換する過程を指す。この過程では、細胞の形態や機能が変化し、細胞間の接着性が低下したり、運動性が増加したりする。これにより、細胞はより移動性を持つようになり、例えばがん細胞が腫瘍から離れて転移する際に重要な役割を果たすことがあり、治療抵抗性や予後の悪化と関連付けられることがある。EMTは細胞内の転写因子やシグナル伝達経路によって調節されることが知られており、細胞の状態を制御する様々なメカニズムが解明されつつある。
4 酸化的リン酸化
酸化的リン酸化(oxidative phosphorylation)は、細胞内での主要なエネルギー生成過程の一つ。この過程は細胞のミトコンドリア内で行われ、食物から取り込まれた栄養素(主に糖類、脂肪、アミノ酸)が酸化されてエネルギーが放出される。酸化的リン酸化は、有酸素条件下での主要なエネルギー供給源であり、細胞の機能に不可欠である。また、酸化的リン酸化が正常に行われるためには、適切な酸素供給やミトコンドリアの機能が重要である。
5 がん精密医療
がん患者さんが個々に有する遺伝子・タンパク質・代謝物等の特徴から個人レベルで最適な治療方法を分析・選択し、それを施すこと。
6 分子標的治療薬
体内の特定の標的分子を狙い撃ちし、その機能を制御することによって、病気を治療する目的で開発された薬剤。
医薬基盤・健康・栄養研究所について
2015年4月1日に医薬基盤研究所と国立健康・栄養研究所が統合し、設立されました。本研究所は、メディカルからヘルスサイエンスまでの幅広い研究を特⾧としており、我が国における科学技術の水準の向上を通じた国民経済の健全な発展その他の公益に資するため、研究開発の最大限の成果を確保することを目的とした国立研究開発法人として位置づけられています。
ウェブサイト:https://www.nibiohn.go.jp/
国立がん研究センター中央病院について
国立がん研究センター中央病院は、1962年に開設して以来、“社会と協働し、全ての国民に最適ながん医療を提供する”という理念のもと、がん治療・研究のリーディング・ホスピタルとして日本のがん医療を牽引しています。全ての臓器がんにおいてハイボリュームで質の高い医療提供体制を構築しており、多数の企業治験や医師主導治験、ファースト・イン・ヒューマン(FIH)試験、国際共同治験・臨床試験を強力に推進し、標準医療の確立と普及に取り組んでいます。
ウェブサイト:https://www.ncc.go.jp/jp/ncch/index.html

このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
