東京大学とちとせ研究所、抗体医薬品製造プロセスのデジタル設計に新展開
――自動化実験データをフル活用した培養工程の数理モデル構築――
国立大学法人東京大学
株式会社ちとせ研究所

発表のポイント
-
モノクローナル抗体製造の培養工程に関して、自動化実験で得たデータから、目的生成物や不純物の濃度を、広範な培養条件で精度良く予測できる新規数理モデルを構築しました。
-
構築した数理モデルにより、不純物濃度の基準値を満たす培養条件の「デザインスペース」や、抗体濃度を最大化する最適条件を、シミュレーションで特定できるようになりました。
-
本研究の成果は、自動化実験と数理モデルの融合による、デジタル技術を利用したプロセス設計に道を開くもので、医薬品プロセス開発の加速や新薬の迅速な上市に貢献します。
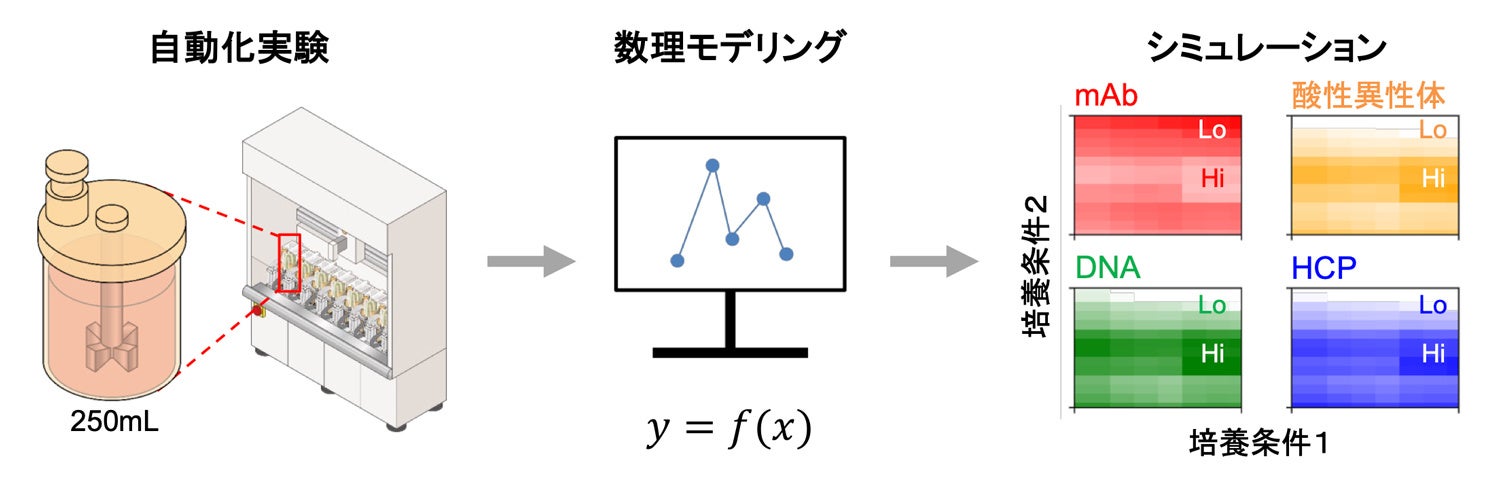
概要
東京大学大学院工学系研究科化学システム工学専攻の根本 耕輔 大学院生、吉山 有希 大学院生、林 勇佑 助教、バドラ サラ 准教授、杉山 弘和 教授、ちとせグループの中核法人である株式会社ちとせ研究所の森笹 瑞季 研究員、岩渕 順真 研究員らの研究グループは、モノクローナル抗体(Monoclonal antibody:mAb)(注1)製造の培養工程について、目的生成物の抗体や複数の不純物の濃度を、広範な培養条件で精度良く予測できる新規数理モデルを構築しました。本モデルにより、好適な培養条件をシミュレーションで特定できることを示しました。
がんやアルツハイマー病などの重病治療において重要な役割を果たすmAbは、動物細胞を培養して抗体を産生させ、分離・精製することで製造されます。培養工程では、多くの設計変数が存在しますが、これらを同時に取り扱える数理モデルの構築は困難であり、シミュレーションによる設計に向けた障壁となっていました。本研究では、自動培養装置で得た実験データをもとに、mAbのみならず複数の不純物の濃度を記述できる数理モデルを構築し、その予測精度を実験的に確認しました。構築したモデルにより、不純物濃度の基準値を満たす培養条件のデザインスペース(注2)や、抗体濃度を最大化する最適条件を、シミュレーションで特定できるようになりました。この成果は、デジタル技術による医薬品プロセス開発の加速に貢献するものです。研究では、小規模・並列化された自動培養装置が活用され、自動化実験と数理モデリングを融合するアプローチの有用性が示されました。
本研究成果は、2026年2月12日(日本時間)に学術誌「AIChE Journal」のオンライン版(オープンアクセス)で公開されます。
発表内容
① 研究背景
バイオ医薬品の有効成分として代表的なmAbは、がんやアルツハイマー病など重篤な疾患の治療において必須であり、その市場は近年、急速に拡大しています。mAbは、まず培養工程(図1)において、動物細胞に抗体を産生させ、その後の分離・精製を経て製造されます。培養工程では、目的生成物であるmAbに加えて複数の不純物が生成され、これらは後続の精製工程で除去されます。精製工程は多くのコストを要するため、培養工程で不純物濃度を低く抑えつつ、mAb濃度を最大化することが求められます。
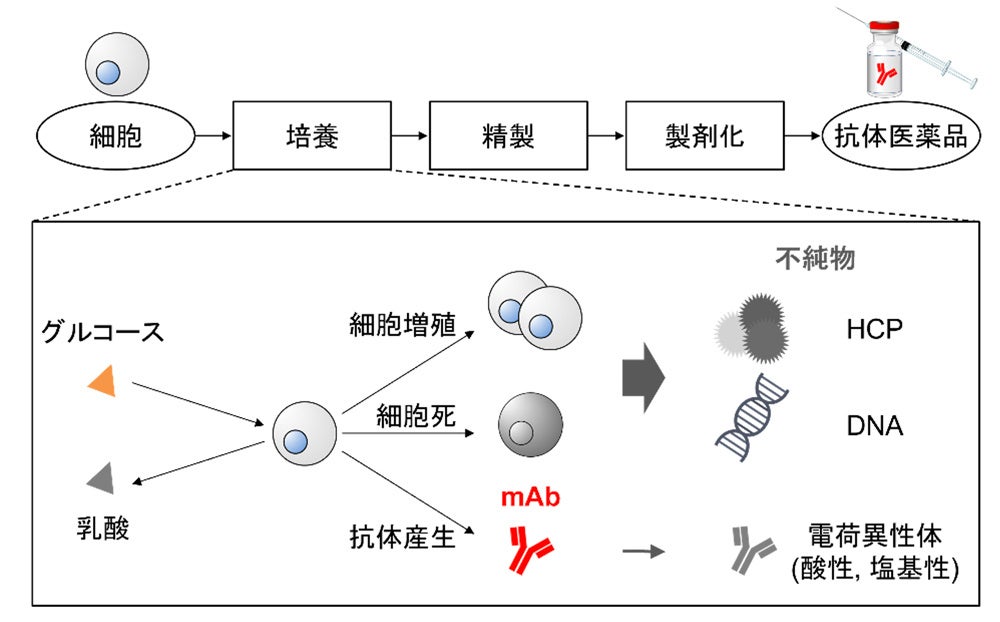
製薬産業では、品質要求を設計段階から満たすためのクオリティ・バイ・デザイン(Quality by Design:QbD)(注5)の考え方が推奨されています。その手段として、数理モデルの活用による試行錯誤的な実験からの脱却が注目されており、近年では特に、培養工程の数理モデルが盛んに研究されています。しかし、無数の生物学的現象が同時に進行する培養工程を対象に、複数の不純物を考慮しつつ、広範な培養条件に適用可能な数理モデルを構築することは極めて困難であり、数理モデルを用いた設計の大きな障壁となっていました。
② 研究内容と成果
本研究では、自動培養実験で取得したデータを用いて新規数理モデルを構築し、シミュレーションによるデザインスペース特定や培養条件最適化を可能にしました。250mLスケールの小型培養槽を12個並列化した自動培養装置を用い、CHO-MK細胞の培養実験を29条件で実施しました。この際、撹拌速度や溶存酸素濃度など6つの設計変数を設定し、幅広い培養条件で十分量の実験データを取得しました。これをもとに、物質収支を基礎とする物理モデル(注6)と、物理モデル中の反応速度定数を予測するデータ駆動型モデル(注7)を融合した、ハイブリッドモデル(注8)を構築しました。15条件で検証実験を実施したところ、12条件で高い予測精度が確認され、適用範囲の広さを示すことができました(図2)。続いて、モデルを用いて、6つの設計変数についてシミュレーションを行った結果、培養時における各成分の濃度に関するヒートマップ(図3)や、複数種類の不純物を考慮したデザインスペース、抗体産生を最大化する設計変数の最適な組み合わせ(図4)を得ることができました。
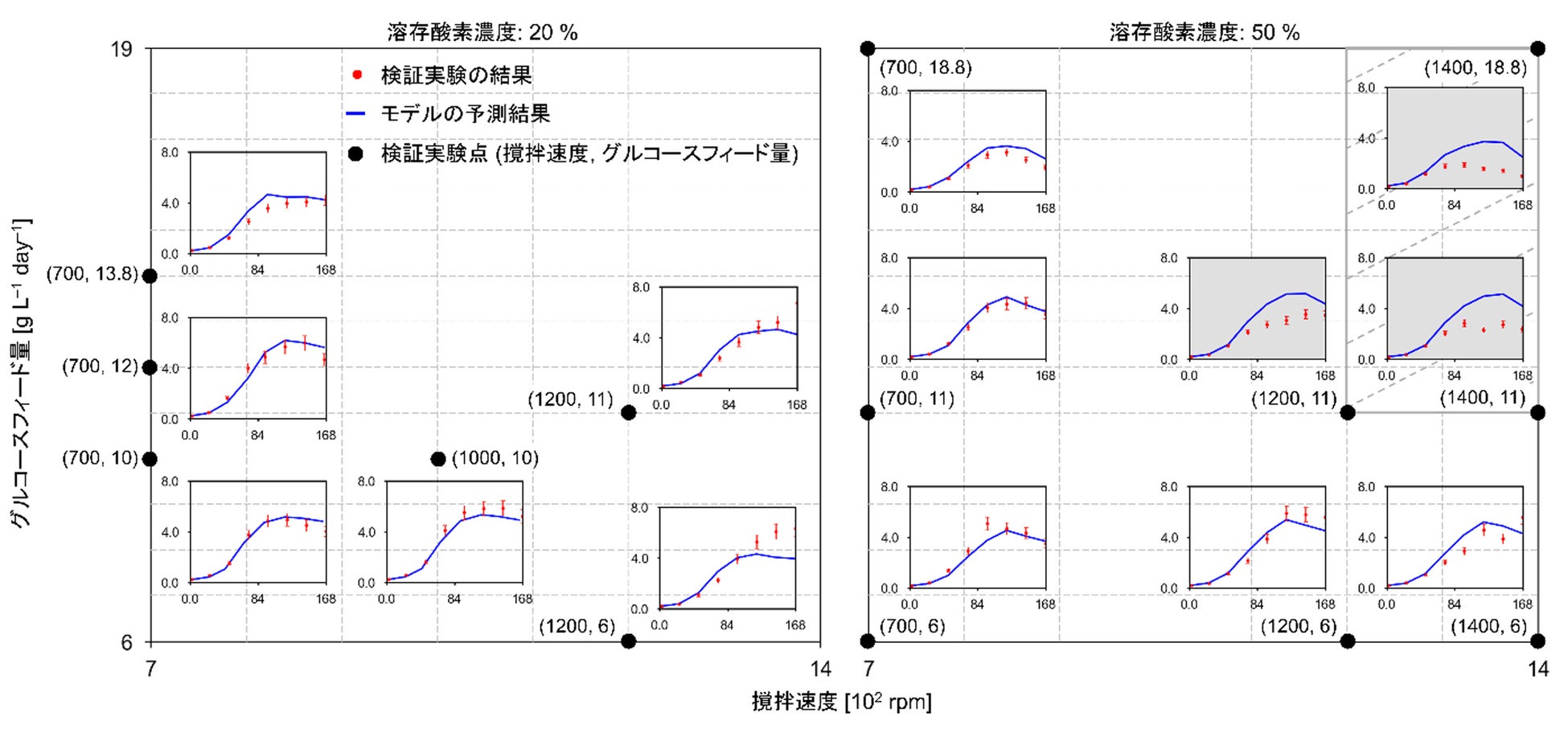
広範な培養条件(12条件)で高い予測精度が確認された。
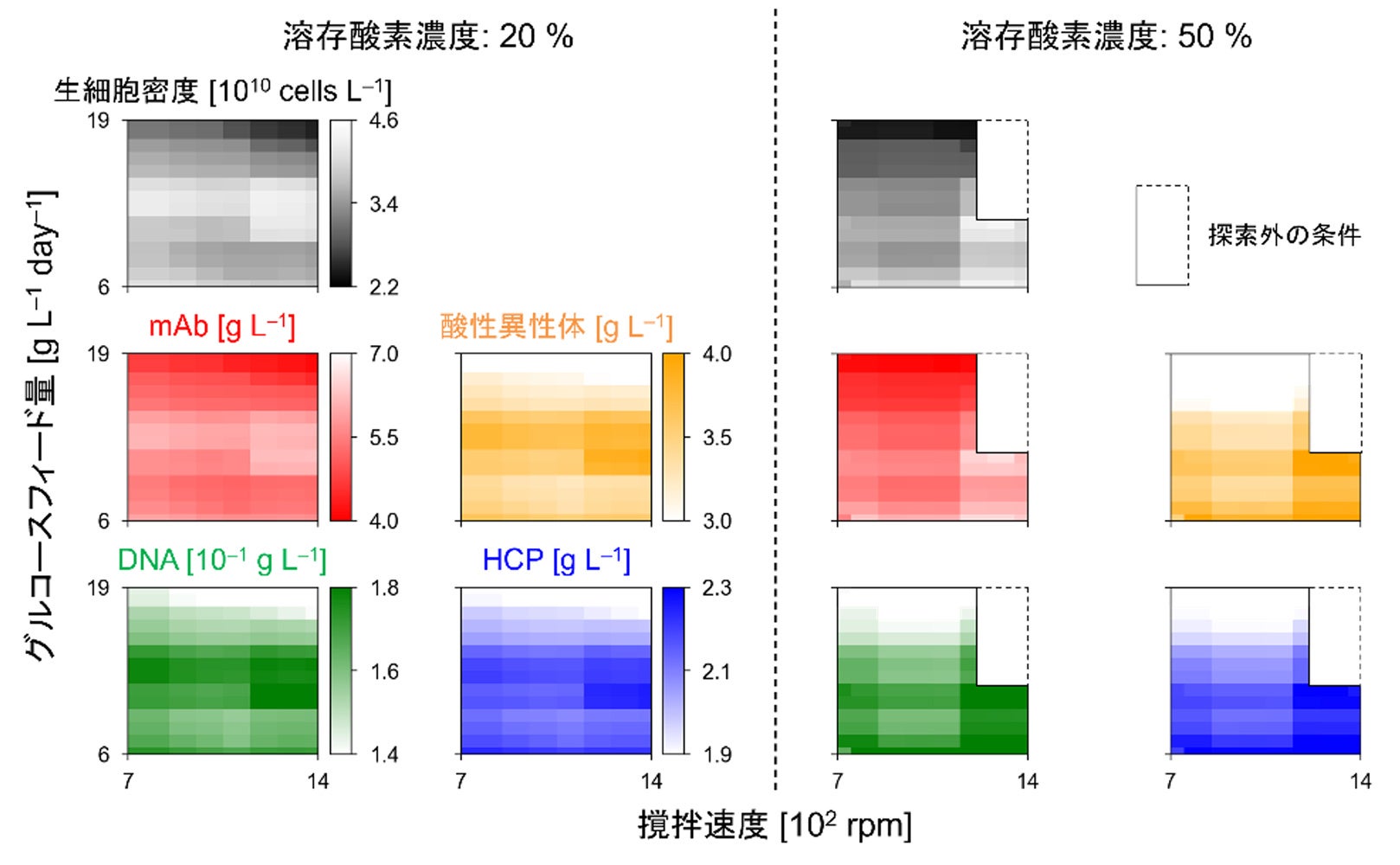
生細胞密度とmAbのグラフでは色が薄いほど値が高く、その他のグラフでは色が薄いほど値が低い。
色が薄いほど好ましい結果を表す。右図右上の白い領域は、モデルの予測精度が低いため対象外とした。
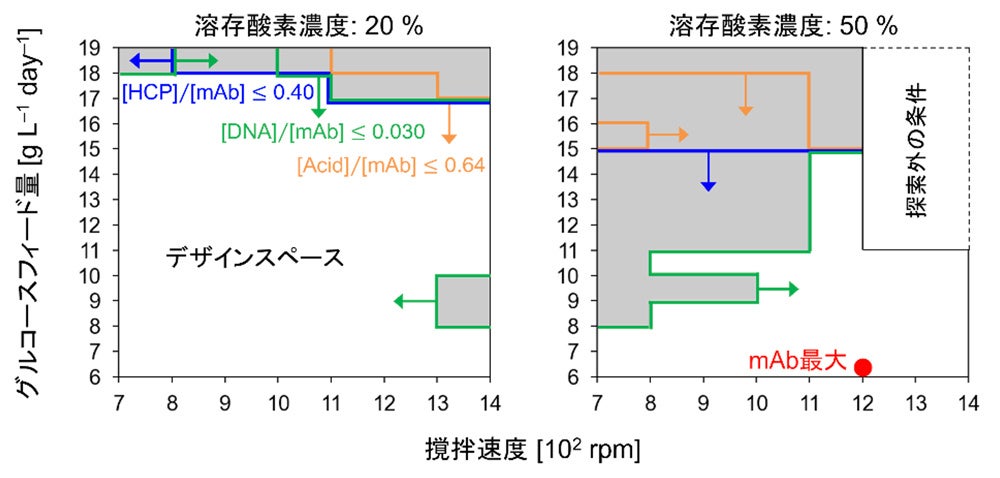
青・緑・オレンジの線はそれぞれ、不純物であるHCP・DNA・酸性電荷異性体の制約条件を示す。
右図右上の白い領域は、モデルの予測精度が十分でないため、探索の対象外とした。
③ 今後の展望
本研究では、自動培養実験で得られたデータをもとに、抗体から複数不純物までの濃度を広範な培養条件で精度良く記述できる新規数理モデルを構築し、シミュレーションによる好適培養条件の特定を可能にしました。今後は、自動化実験と数理モデリングのさらなる融合や、後続の精製工程までも含めた全体プロセスの設計へと研究を展開します。本研究を通じて、デザインスペース構築やプロセス最適化に向けたデジタル技術をさらに発展させ、医薬品プロセス開発のさらなる迅速化・効率化に貢献します。
発表者・研究者等情報
東京大学 大学院工学系研究科 化学システム工学専攻
根本 耕輔 博士課程
吉山 有希 博士課程
林 勇佑 助教
バドラ サラ 准教授
杉山 弘和 教授
株式会社ちとせ研究所
森笹 瑞季 研究員(Senior BioEngineer)
岩渕 順真 研究員(Principal BioEngineer)
論文情報
雑誌名:AIChE Journal
題 名:Hybrid modeling for optimizing cell cultivation in mAb production using a small-scale automated experimental platform
著者名:Kosuke Nemoto, Yuki Yoshiyama, Mizuki Morisasa, Junshin Iwabuchi, Yusuke Hayashi, Sara Badr, Hirokazu Sugiyama*
* 責任著者
DOI:10.1002/aic.70231
URL:https://doi.org/10.1002/aic.70231
研究助成
本研究は、AMED次世代治療・診断実現のための創薬基盤技術開発事業(国際競争力のある次世代抗体医薬品製造技術開発)「バイオ医薬製造プロセスの開発・制御のためのデジタルプラットフォーム」(代表:杉山弘和)の研究として行われたものです。また、JST次世代研究者挑戦的研究プログラムSPRING(JPMJSP2108)の支援も受けました。
用語解説
(注1)モノクローナル抗体(Monoclonal antibody:mAb):動物の免疫システムでは、体内に侵入した細菌などの異物(抗原)を検知すると「抗体」と呼ばれるタンパク質が作られる。モノクローナル抗体は、抗原にある目印(抗原決定基)のうち、特定の一種類とだけ結合する抗体を人工的に増殖させたものである。モノクローナル抗体を有効成分とする抗体医薬品は、抗原抗体反応を利用してがんやアルツハイマー病などの疾病の治療に用いられる。
(注2)デザインスペース:品質を確保することが示されている入力変数と工程パラメータの多元的な組み合わせ。医薬品規制調和国際会議の品質に関するガイドラインQ8(R2)で定義されている。
(注3)宿主細胞由来タンパク質(Host cell protein:HCP):抗体医薬品製造における工程由来不純物のうち、細胞に由来する、目的物質以外のタンパク質の総称である。
(注4)電荷異性体:mAb分子の電荷が本来の主要な成分(メイン体)と異なる変異体を指す。電荷が酸性側または塩基性側にシフトしたものがあり、それぞれ酸性電荷異性体、塩基性電荷異性体と呼ばれる。目的物質由来不純物に類別される。
(注5)クオリティ・バイ・デザイン(Quality by Design:QbD):事前の目標設定に始まり、製品及び工程の理解並びに工程管理に重点をおいた、立証された科学及び品質リスクマネジメントに基づく体系的な開発手法。医薬品規制調和国際会議の品質に関するガイドラインQ8(R2)で定義されている。
(注6)物理モデル:物理・化学・生物学的な原理に基づいて記述されるモデルを指す。現象に対する十分な理解がある限り、信頼性が高く、外挿性に優れるという利点がある。「メカニスティックモデル」「ファンダメンタルモデル」「ホワイトボックスモデル」とも呼ばれる。
(注7)データ駆動型モデル:モデルの入出力関係のみに基づいて記述されるモデルを指す。モデル化したい現象の機構について十分な理解がない場合でも、良質なデータが十分にあれば容易にモデルを構築しうるという利点がある。「統計モデル」「ブラックボックスモデル」とも呼ばれる。
(注8)ハイブリッドモデル:物理モデルとデータ駆動型モデルを組み合わせたモデルを指す。精度を高めつつ、解釈可能性を維持することを目的としている。「グレイボックスモデル」とも呼ばれる。
東京大学について
1877 年に創立された我が国最初の国立大学である東京大学は、15 の学部・研究科と 11 の附置研究所を有する教育研究機関です。藤井 輝夫総長により 2021 年 9 月に公表された基本方針「UTokyo Compass~多様性の海へ:対話が創造する未来(Into a Sea of Diversity: Creating the Future through Dialogue)~」のもと、様々なステークホルダーと協調して社会課題を解決していくことをめざしています。
https://www.u-tokyo.ac.jp/ja/index.html
ちとせグループ概要
ちとせグループは、世界のバイオエコノミーをリードするバイオ企業群です。千年先まで人類が豊かに暮らせる環境を残すべく、国や多くの企業と協力し、経済合理性を成立させながら技術を社会に展開しています。
◯ちとせグループ全体を統括する「CHITOSE BIO EVOLUTION PTE. LTD.」の概要
・設立:2011年10月
・本社:シンガポール
・代表者:CEO 藤田朋宏 Ph.D.
◯ちとせグループの中核法人として、技術開発・事業開発を行う「株式会社ちとせ研究所」の概要
・設立:2002年11月
・本社:神奈川県川崎市
・代表者:代表取締役CEO 藤田朋宏 Ph.D./代表取締役COO 釘宮理恵
問合せ先

このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
