慢性腎臓病への悪化を抑制する鍵となる分子を同定
~ Rac1がポドサイトの構造を維持し、糸球体硬化を抑制する ~
順天堂大学医学部腎臓内科学講座の浅尾りん 非常勤助教、鈴木祐介 教授、千葉大学医学部腎臓内科学講座の淺沼克彦 教授らの研究グループは、慢性腎臓病への悪化を抑制する鍵となる分子を同定しました。慢性腎臓病の原因となる糸球体(*1)が硬化する過程において、細胞内タンパクのRac1(*2)とmTOR(*3)が、糸球体足細胞(ポドサイト)(*4)の構造を維持し、糸球体硬化を抑制することを発見しました。この成果はRac1とmTORが慢性腎臓病の新たな治療ターゲットとなる可能性を示しています。本研究は、英科学雑誌Scientific Reports電子版に掲載されました。
【本研究成果のポイント】
【背景】
腎臓の障害が慢性的に続く慢性腎臓病は成人の8人に1人が該当するとされ、新たな国民病として近年注目が集まっています。腎臓は再生する能力がないため、一度深刻な障害を受けると生涯において透析療法を受ける必要があります。そのため、腎臓を保護する薬剤の開発が急務となっています。
私たち研究グループは、慢性腎臓病の新規治療法の開発を目標に、慢性化の原因となる糸球体硬化に注目して研究してきました。腎臓には血液濾過装置である糸球体が存在し、この糸球体のポドサイトが障害を受けると不可逆的変化である糸球体硬化を起こし慢性腎臓病へ悪化します。今までに、ポドサイトの足突起が一時的に消失する形態の可逆的変化に細胞内タンパクのRac1が関与することがわかっていますが、慢性化の引き金となる不可逆的な変化がどのように進むのかは不明でした。そこで、糸球体硬化に至るポドサイトの病態メカニズムを明らかにすることを目的に、本研究ではRac1のポドサイトにおける役割について調べました。
【内容】
まず、糸球体硬化におけるRac1の役割を解明するため、Rac1遺伝子をポドサイト特異的にノックアウト(*5)したマウスを作成しました。定常状態ではコントロール(野生型)マウスとRac1ノックアウトマウスの腎臓に変化はありませんが、ネフローゼ・糸球体硬化モデルであるアドリアマイシン腎症(*6)を引き起こすと、コントロールマウスに比べてRac1ノックアウトマウスでは腎臓組織内に硬化糸球体が増加しました(図1)。
今回の研究により、Rac1がmTORとともにポドサイトの細胞の大きさを保持することで、構造を維持し、糸球体硬化を抑制して不可逆的変化から腎臓を守っていることがわかりました。
【今後の展開】
現在増加傾向にある慢性腎臓病を減らすためには、糸球体硬化をできるだけ早期にくい止める必要があります。Rac1はポドサイトの細胞骨格と関連があることから、今後は、ポドサイト障害における細胞骨格の変化を明らかにする必要があります。細胞骨格の変化を制御できれば、ポドサイトが障害を受けた際の構造変化を最小限にとどめ、糸球体硬化を防いで慢性化を抑制することが期待できます。本研究成果をもとに、Rac1とmTORをターゲットとした新薬の開発に繋げていきたいと考えています。
【用語解説】
*1 糸球体: 腎臓に存在し、数本の毛細血管が球状に絡まった構造をしている。糸球体に流れ込んだ血液から老廃物や余分な水分を排泄し、体にとって必要なたんぱくなどを体内に保持する、いわゆる血液ろ過を行う装置。
*2 Rac1: 様々な細胞に存在し、細胞の骨格に働きかける蛋白。細胞の形態形成や運動性を制御するシグナル伝達の中心的な役割を果たしている。
*3 mTOR(mammalian target of rapamycin): 免疫抑制作用や細胞増殖抑制作用のある薬剤であるラパマイシンの標的分子であり、細胞内外からのさまざまなシグナルを感知し、細胞の成長、増殖や代謝などの調整に重要な役割を果たしている。
*4 糸球体足細胞(ポドサイト) : 糸球体毛細血管壁を外側から支えている糸球体足細胞(ポドサイト)は、多数の足突起を持っており、隣り合うポドサイト同士その足突起をかみ合わせながら存在している。障害を受けることでこの構造が変化し、いずれ毛細血管壁(糸球体基底膜)から剥がれ落ちてしまう。
*5 ノックアウト: ある特定の遺伝子のDNA塩基配列を破壊して、遺伝子発現を阻害すること。
*6 アドリアマイシン腎症: 抗悪性腫瘍剤(抗がん剤)の一種であるアドリアマイシンをマウスに経静脈的に投与すると、蛋白尿を生じ、ポドサイト障害が引き起こされ糸球体硬化に至る。そのため、アドリアマイシンを投与されたマウスはネフローゼ症候群と糸球体硬化症の疾患モデルとして使用されている。
*7 ノックダウン: 特定の蛋白質のmRNA(メッセンジャーRNA)に相補的な短いRNAを細胞内に導入することで、RNA干渉により特定の遺伝子発現を抑制すること。
【原著論文】
本研究は、Nature Publishing Groupの電子版雑誌「Scientific Reports」(https://www.nature.com/articles/s41598-018-23278-6 )で2018年3月22日に公開されました。
DOI: 10.1038/s41598-018-23278-6
タイトル:Rac1 in podocytes promotes glomerular repair and limits the formation of sclerosis.
日本語訳:ポドサイトにおけるRac1は糸球体硬化への進展を抑制する。
著者:Rin Asao, Takuto Seki, Miyuki Takagi , Hiroyuki Yamada, Fumiko Kodama ,Yoshiko Hosoe-Nagai, Eriko Tanaka, Juan Alejandro Oliva Trejo, Kanae Yamamoto-Nonaka, Yu Sasaki, Teruo Hidaka,
Takashi Ueno, Motoko Yanagita, Yusuke Suzuki, Yasuhiko Tomino, and Katsuhiko Asanuma
本研究は、JSPS科研費基盤研究(C) (JP23591201)、 JSPS科研費若手研究(B) (JP24790858) (JP24790856) (JP23790956) (JP15K19467)、かなえ医薬振興財団、興和生命科学振興財団、
武田科学振興財団などの助成を受け実施されました。
- 慢性腎臓病の原因となる糸球体硬化をRac1が抑制した
- ポドサイトの構造維持にRac1とmTORが必要である
- Rac1およびmTORが新薬開発のターゲットとなる可能性
【背景】
腎臓の障害が慢性的に続く慢性腎臓病は成人の8人に1人が該当するとされ、新たな国民病として近年注目が集まっています。腎臓は再生する能力がないため、一度深刻な障害を受けると生涯において透析療法を受ける必要があります。そのため、腎臓を保護する薬剤の開発が急務となっています。
私たち研究グループは、慢性腎臓病の新規治療法の開発を目標に、慢性化の原因となる糸球体硬化に注目して研究してきました。腎臓には血液濾過装置である糸球体が存在し、この糸球体のポドサイトが障害を受けると不可逆的変化である糸球体硬化を起こし慢性腎臓病へ悪化します。今までに、ポドサイトの足突起が一時的に消失する形態の可逆的変化に細胞内タンパクのRac1が関与することがわかっていますが、慢性化の引き金となる不可逆的な変化がどのように進むのかは不明でした。そこで、糸球体硬化に至るポドサイトの病態メカニズムを明らかにすることを目的に、本研究ではRac1のポドサイトにおける役割について調べました。
【内容】
まず、糸球体硬化におけるRac1の役割を解明するため、Rac1遺伝子をポドサイト特異的にノックアウト(*5)したマウスを作成しました。定常状態ではコントロール(野生型)マウスとRac1ノックアウトマウスの腎臓に変化はありませんが、ネフローゼ・糸球体硬化モデルであるアドリアマイシン腎症(*6)を引き起こすと、コントロールマウスに比べてRac1ノックアウトマウスでは腎臓組織内に硬化糸球体が増加しました(図1)。
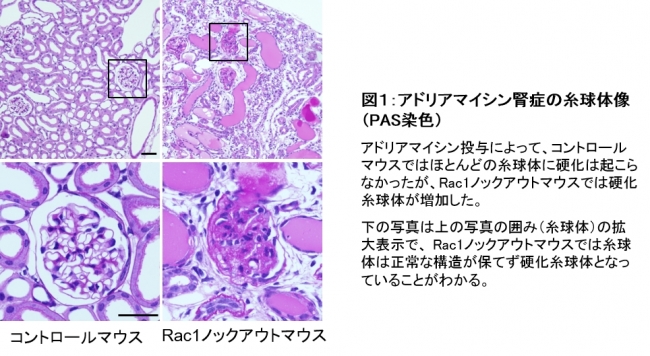 図1:アドリアマイシン腎症の糸球体像(PAS染色)
図1:アドリアマイシン腎症の糸球体像(PAS染色)
 図2:アドリアマイシン投与後のポドサイトの体積変化
図2:アドリアマイシン投与後のポドサイトの体積変化
つまり、Rac1の存在により、ポドサイトの細胞の大きさが保たれ、構造を維持することにより糸球体硬化を抑制していることがわかりました。
そこでさらに、ポドサイトにおけるRac1と細胞の大きさに関与するキナーゼタンパクのmTORとの関係を調べました。 まず、コントロールマウスにアドリアマイシンを投与するとポドサイトにおいてmTORの活性化が見られましたが、 Rac1ノックアウトマウスでは抑えられていました(図3)。
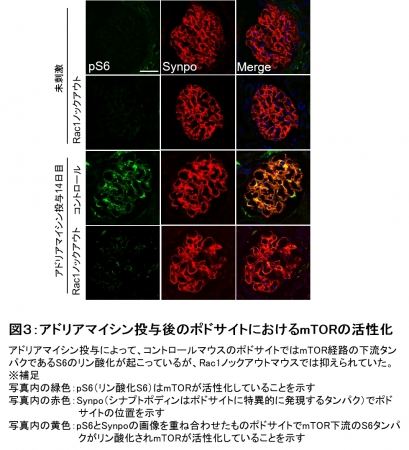 図3:アドリアマイシン投与後のポドサイトにおけるmTORの活性化
図3:アドリアマイシン投与後のポドサイトにおけるmTORの活性化
今回の研究により、Rac1がmTORとともにポドサイトの細胞の大きさを保持することで、構造を維持し、糸球体硬化を抑制して不可逆的変化から腎臓を守っていることがわかりました。
【今後の展開】
現在増加傾向にある慢性腎臓病を減らすためには、糸球体硬化をできるだけ早期にくい止める必要があります。Rac1はポドサイトの細胞骨格と関連があることから、今後は、ポドサイト障害における細胞骨格の変化を明らかにする必要があります。細胞骨格の変化を制御できれば、ポドサイトが障害を受けた際の構造変化を最小限にとどめ、糸球体硬化を防いで慢性化を抑制することが期待できます。本研究成果をもとに、Rac1とmTORをターゲットとした新薬の開発に繋げていきたいと考えています。
【用語解説】
*1 糸球体: 腎臓に存在し、数本の毛細血管が球状に絡まった構造をしている。糸球体に流れ込んだ血液から老廃物や余分な水分を排泄し、体にとって必要なたんぱくなどを体内に保持する、いわゆる血液ろ過を行う装置。
*2 Rac1: 様々な細胞に存在し、細胞の骨格に働きかける蛋白。細胞の形態形成や運動性を制御するシグナル伝達の中心的な役割を果たしている。
*3 mTOR(mammalian target of rapamycin): 免疫抑制作用や細胞増殖抑制作用のある薬剤であるラパマイシンの標的分子であり、細胞内外からのさまざまなシグナルを感知し、細胞の成長、増殖や代謝などの調整に重要な役割を果たしている。
*4 糸球体足細胞(ポドサイト) : 糸球体毛細血管壁を外側から支えている糸球体足細胞(ポドサイト)は、多数の足突起を持っており、隣り合うポドサイト同士その足突起をかみ合わせながら存在している。障害を受けることでこの構造が変化し、いずれ毛細血管壁(糸球体基底膜)から剥がれ落ちてしまう。
*5 ノックアウト: ある特定の遺伝子のDNA塩基配列を破壊して、遺伝子発現を阻害すること。
*6 アドリアマイシン腎症: 抗悪性腫瘍剤(抗がん剤)の一種であるアドリアマイシンをマウスに経静脈的に投与すると、蛋白尿を生じ、ポドサイト障害が引き起こされ糸球体硬化に至る。そのため、アドリアマイシンを投与されたマウスはネフローゼ症候群と糸球体硬化症の疾患モデルとして使用されている。
*7 ノックダウン: 特定の蛋白質のmRNA(メッセンジャーRNA)に相補的な短いRNAを細胞内に導入することで、RNA干渉により特定の遺伝子発現を抑制すること。
【原著論文】
本研究は、Nature Publishing Groupの電子版雑誌「Scientific Reports」(https://www.nature.com/articles/s41598-018-23278-6 )で2018年3月22日に公開されました。
DOI: 10.1038/s41598-018-23278-6
タイトル:Rac1 in podocytes promotes glomerular repair and limits the formation of sclerosis.
日本語訳:ポドサイトにおけるRac1は糸球体硬化への進展を抑制する。
著者:Rin Asao, Takuto Seki, Miyuki Takagi , Hiroyuki Yamada, Fumiko Kodama ,Yoshiko Hosoe-Nagai, Eriko Tanaka, Juan Alejandro Oliva Trejo, Kanae Yamamoto-Nonaka, Yu Sasaki, Teruo Hidaka,
Takashi Ueno, Motoko Yanagita, Yusuke Suzuki, Yasuhiko Tomino, and Katsuhiko Asanuma
本研究は、JSPS科研費基盤研究(C) (JP23591201)、 JSPS科研費若手研究(B) (JP24790858) (JP24790856) (JP23790956) (JP15K19467)、かなえ医薬振興財団、興和生命科学振興財団、
武田科学振興財団などの助成を受け実施されました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
