酢酸による免疫グロブリンAの機能制御
-腸内細菌の制御につながる新しい分子メカニズムの解明-
2021年7月14日
理化学研究所
株式会社ダイセル
日本医療研究開発機構
理化学研究所(理研)生命医科学センター粘膜システム研究チームの竹内直志研修生、大野博司チームリーダーらの国際共同研究グループ※は、腸内細菌の主要な代謝物である「酢酸」が「免疫グロブリンA(IgA)[1]」の細菌反応性を変化させることで腸内細菌の制御に関与することを発見しました。
本研究成果は、腸内細菌がその代謝物を介してIgAの機能制御に重要な役割を果たしていることを示しており、今後、IgAの機能制御に関する理解を進めることで、腸内細菌の新しい制御法の開発につながるものと期待できます。
IgAは腸内細菌を標的とする主要な免疫グロブリンですが、IgAと腸内細菌の相互作用がどのように制御されているかは明らかになっていませんでした。
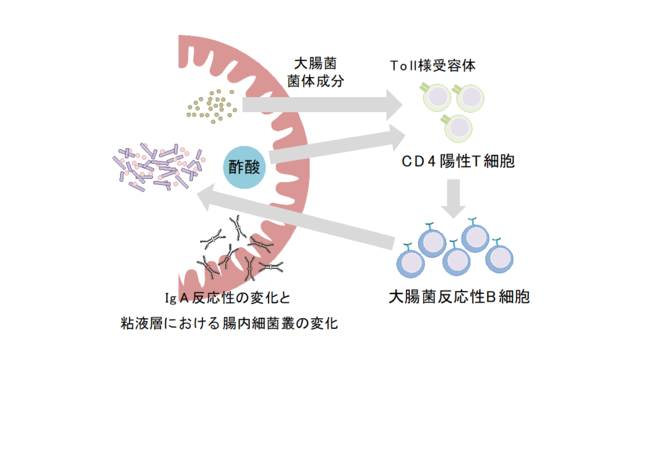
今回、国際共同研究グループは、酢酸によって誘導されるIgAが大腸菌などの病原性片利共生細菌[2]に結合し、大腸表面の粘液層への侵入を阻止することを明らかにしました。また、その作用機序として、酢酸が菌体成分[3]とともにIgA産生をサポートするCD4陽性T細胞[4]の機能を強化することで、大腸菌反応性のIgAを増加させることも明らかにしました。免疫システムは腸内細菌代謝物の刺激によってIgA産生のパターンを変化させることで、腸内細菌を制御しているものと考えられます。
本研究は、科学雑誌『Nature』オンライン版(7月14日付:日本時間7月15日)に掲載されます。
※国際共同研究グループ
理化学研究所 生命医科学研究センター
粘膜システム研究チーム
チームリーダー 大野 博司 (おおの ひろし)
研修生/研究パートタイマーⅠ 竹内 直志 (たけうち ただし)
研究員 宮内 栄治 (みやうち えいじ)
上級研究員 金谷 高史 (かなや たかし)
研究員 加藤 完 (かとう たもつ)
研究員 中西 裕美子(なかにし ゆみこ)
客員研究員 對田 尚 (たいだ たかし)
基礎科学特別研究員 佐々木 崇晴(ささき たかはる)
大学院生(研究当時) 根岸 紘生 (ねぎし ひろき)
統合ゲノミクス研究チーム
チームリーダー(研究当時) 小原 收 (おはら おさむ)
上級研究員(研究当時) 渡辺 貴志 (わたなべ たかし)
代謝ネットワーク研究チーム
チームリーダー 北見 俊守 (きたみ としもり)
株式会社ダイセル
事業創出本部 事業創出センター
主席部員 島本 周 (しまもと しゅう)
ヘルスケアSBU 事業推進室 事業戦略グループ
アドバイザー 松山 彰収 (まつやま あきのぶ)
京都大学大学院 生命科学研究科 生体システム学
教授 木村 郁夫 (きむら いくお)
エモリー大学 医学部 病理学教室
教授 イフォー・ウィリアムズ(Ifor R. Williams)
研究支援
本研究は、理化学研究所共生生物学プロジェクト、日本学術振興会(JSPS)科学研究費補助金若手研究(B)「腸内細菌による中枢神経系炎症制御メカニズムの解析(研究代表者:宮内栄治)」、および日本医療研究開発機構(AMED) 革新的先端研究開発支援事業(AMED-CREST)『疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出』研究開発領域(研究開発総括:清水 孝雄)における研究開発課題名「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築(研究開発代表者:大野博司)」による支援を受けて行われました。
1.背景
私たちヒトの腸管には40兆にも及ぶ細菌が生息しており、それらは腸内細菌と呼ばれています。腸内細菌はヒトに不可欠な栄養素を産生したり、外来の病原菌を排除したりすることで、ヒトの健康維持に貢献しています。一方、過剰な細菌を制御できなければ、細菌の体内移行に伴う感染症が引き起こされる可能性もあることから、腸内細菌の制御機構の解明は細菌との共生関係において重要な課題です。さらに近年、腸内細菌が中枢神経や肥満・糖尿病などのさまざまな全身疾患に関与することが明らかになっており、腸内細菌を制御することで疾患の感受性を変化させられる可能性も示されています。
「免疫グロブリンA(IgA)」はヒト体内で最も多く産生される免疫グロブリンであり、主に腸管などの粘膜面から分泌されます。IgAは腸内細菌に結合することで、腸内細菌の増殖・定着・機能を制御していると考えられています。しかし、ダイナミックに変化する腸内環境に対応して、腸内細菌に対するIgAの反応性がどのように調節されるかは分かっていませんでした。
近年の報告から、腸内細菌が産生する代謝物が、腸管における免疫機能に大きな影響を与えていることが判明しつつあります。特に、腸内細菌の主要な代謝物である「短鎖脂肪酸[5]」は、制御性T細胞や自然リンパ球など多くの免疫細胞の誘導・機能の制御に関与することが知られています。IgAについても、短鎖脂肪酸がその分泌量を増加させる可能性が以前から示されていました。そこで今回は、短鎖脂肪酸がIgAの機能制御にも関与するのではないかとの仮説を立て、実験的に検証しました。
2.研究手法と成果
国際共同研究グループはまず、短鎖脂肪酸を腸管内で特異的に増加させる「短鎖脂肪酸付加セルロース」という飼料をマウスに投与し、大腸で局所的に短鎖脂肪酸の濃度を高めました。すると、短鎖脂肪酸の一種である「酢酸」を付加したセルロース(酢酸セルロース)の投与により、IgA産生細胞やIgA分泌量が増加すること、また、IgAの腸内細菌に対する結合率も増加していることが分かりました(図1)。一方、同様に他の短鎖脂肪酸であるプロピオン酸、酪酸の効果も調べましたが、IgAの量などに変化は見られませんでした。
図1 酢酸によるIgA産生および腸内細菌結合率の増加
a: 酢酸セルロースの投与により、マウス糞便中の腸管分泌IgAが増加した。
b: 酢酸セルロースの投与により、マウス糞便中の細菌に対するIgAの結合率が上昇した。
**P < 0.01.
次に、IgAシークエンシング[6]を用いて、酢酸セルロース投与に伴う大腸内でのIgA結合細菌のパターン変化を調べました。その結果、コントロールマウスのIgAはBacteroidales目など一般的な共生細菌に多く結合する一方、酢酸セルロース投与マウスのIgAはEnterobacterales目に属する大腸菌など病原性片利共生細菌に結合することが明らかになりました(図2)。
図2 酢酸によるIgA結合細菌パターンの変化
左: 一般的な共生細菌であるBacteroidales目へのIgA非結合とIgA結合の割合。IgA結合の割合は、酢酸セルロース投与マウスよりもコントロールマウスの方が高かった。
右: 大腸菌など病原性片利共生細菌であるEnterobacterales目へのIgA非結合とIgA結合の割合。IgA結合の割合は、コントロールマウスよりも酢酸セルロース投与マウスの方が高かった。
*P < 0.05、**P < 0.01.
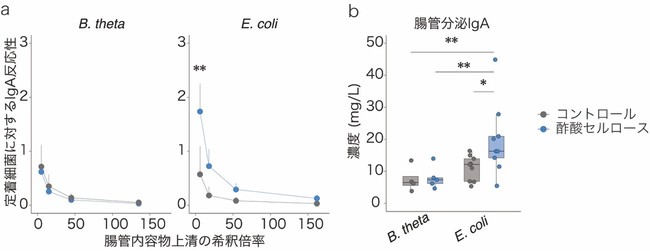
このIgAシークエンシングの結果を検証するために、無菌マウス[7]に大腸菌(E. coli)もしくは一般的な共生細菌のBacteroides thetaiotaomicron(B. theta)をそれぞれ腸管内に定着させたマウスを作製し、酢酸セルロース投与の効果を調べました。すると、大腸菌定着マウスにおいてのみ、大腸内のIgAが増加することが分かりました(図3a)。また、加熱殺菌処理した大腸菌を無菌マウスに投与した際にも、IgAが増加しました(図3b)。以上の結果から、酢酸セルロースのIgAに対する効果は腸内細菌を構成している菌体成分に依存的であり、特に病原性片利共生細菌に対してIgAを産生させることが分かりました。
a: B. theta定着マウスでは、コントロールと酢酸セルロース投与によるIgA反応性に差は見られなかったが(左)、大腸菌(E. coli)定着マウスでは、酢酸セルロース投与によりIgA反応性が増加した(右)。
b: 加熱殺菌処理B. thetaを投与した無菌マウスでは、コントロールと酢酸セルロース投与によるIgA産生の差は見られなかったが、加熱殺菌処理大腸菌(E. coli)を投与した無菌マウスでは、酢酸セルロース投与によりIgA産生が増加した。
*P < 0.05、**P < 0.01.
次に、酢酸セルロースによって大腸で増加するIgAの腸管内での機能を調べました。酢酸セルロースにより野生型マウスでは、特に大腸表面の粘液層の腸内細菌組成が変化したのに対して、IgAを産生できなくしたAID欠損マウス[8]では酢酸セルロースを投与しても、粘液層の腸内細菌組成は変化しませんでした。
また、マウスに緑色蛍光陽性大腸菌[9]を投与したところ、酢酸セルロースにより増加したIgAは大腸菌に結合し、特に粘液層への侵入を阻止していることが分かりました(図4)。以上の結果から、酢酸セルロースによって誘導される大腸内のIgAは、粘液層における病原性片利共生細菌の定着・侵入を阻止することが明らかになりました。
図4 酢酸とIgAによる大腸菌の粘液層侵入に対する効果
酢酸セルロース投与により、大腸粘液層における緑色蛍光陽性大腸菌の相対的な存在量が減少した。
*P < 0.05.
最後に、酢酸セルロースが特定の細菌に対してIgAを誘導する作用機序を調べました。IgA産生には、CD4陽性T細胞のサポートを必要とする経路(T細胞依存性IgA産生[10])と必要としない経路(T細胞非依存性IgA産生)の2種類があります。そこで、まず試験管内でB細胞[10]に酢酸ナトリウムと加熱処理した大腸菌(E. coli)またはB. thetaを添加し、CD4陽性T細胞とともに培養しました。その結果、酢酸と大腸菌の刺激によりIgA産生細胞が増加することが分かりました(図5a)。一方、酢酸はB. thetaとの共刺激では、IgA産生細胞を増加させませんでした(図5a)。
次に、菌体成分の受容体であるToll様受容体[11]を欠損するMyD88・TRIF二重欠損マウスを用いて、菌体成分によるCD4陽性T細胞に対する刺激がIgA産生に影響するかどうかを検証しました。T細胞を持たないCD3ε欠損マウスに、野生型マウスとMyD88・TRIF二重欠損マウスから採取したCD4陽性T細胞を移植し、それらのマウスに酢酸セルロースを投与しました。その結果、野生型マウス由来のCD4陽性T細胞を持つマウスでは、これまでの結果同様に、酢酸セルロース投与によるIgA産生の増加および大腸菌反応性IgAの増加が見られましたが、MyD88・TRIF二重欠損マウス由来のCD4陽性T細胞を持つマウスではIgA産生に差が見られませんでした(図5b)。
図5 酢酸と菌体成分によるCD4陽性T細胞を介したIgA反応性の変化
a: 酢酸ナトリウムと加熱処理した大腸菌(E. coli)は、CD4陽性T細胞依存的にIgA産生B細胞を増加させるが、酢酸ナトリウムと加熱処理したB. thetaiotaomicron(B. theta)の共刺激では変化が見られなかった。
b: 酢酸セルロース投与により、野生型マウス由来CD4陽性T細胞の移植マウスでは、大腸菌(E. coli)反応性IgAが増加した。一方、MyD88/TRIF二重欠損マウス由来CD4陽性T細胞の移植マウスでは大腸菌(E. coli)反応性IgAは変化しなかった。
*P < 0.05、**P < 0.01、***P < 0.001.
以上の結果から、酢酸は菌体成分とともにCD4陽性T細胞を刺激することで、T細胞依存的に大腸菌反応性のIgA産生を増加させることが明らかになりました(図6)。
腸内細菌の代謝物である酢酸は、大腸菌の菌体成分とともにCD4陽性T細胞の機能を強化することでT細胞依存性IgA産生を増加させ、結果として腸内細菌に対するIgA反応性のバランスを変化させる。酢酸は特に大腸菌などの特定の病原性片利共生細菌に対してIgA産生を増加させる。
3.今後の期待
これまでの報告から、同じ細菌種であっても特定の環境下ではIgAに結合したり結合しなかったりすることが示唆されていましたが、なぜIgAと腸内細菌の相互作用が変化するのか、どのように制御されているのか、明らかになっていませんでした。本研究では、腸内細菌の代謝物である酢酸が腸内細菌の菌体成分とともにT細胞依存的IgA産生を増強することでIgAのバランスを変化させること、酢酸が特に病原性片利共生細菌へのIgA産生を増加させることで細菌の腸管内局在性に影響を与えることが明らかになりました。
腸内細菌は消化管だけではなく、中枢神経や肥満・糖尿病など、さまざまな疾患に関与することが明らかになっています。そのため、腸内細菌を制御することが、新しい治療法につながると考えられています。IgAは腸内細菌を制御する主要な免疫システムであり、IgAと腸内細菌の相互作用を理解していくことで、将来的に腸内細菌制御と疾患の予防・治療につながることが期待できます。
4.論文情報
<タイトル>
Acetate differentially regulates IgA reactivity to commensal bacteria
<著者名>
Tadashi Takeuchi, Eiji Miyauchi, Takashi Kanaya, Tamotsu Kato, Yumiko Nakanishi, Takashi Watanabe, Toshimori Kitami, Takashi Taida, Takaharu Sasaki, Hiroki Negishi, Shu Shimamoto, Akinobu Matsuyama, Ikuo Kimura, Ifor R. Williams, Osamu Ohara, Hiroshi Ohno
<雑誌>
Nature
<DOI>
10.1038/s41586-021-03727-5
5.補足説明
[1] 免疫グロブリンA(IgA)
B細胞によって産生される免疫グロブリンは、M、D、G、E、Aの五つのクラスに分類される。そのうち、IgAは生体内で最も多く産生される免疫グロブリンであり、主に腸管などの粘膜面から分泌される。IgAは腸内細菌と結合することで、腸内細菌の侵入、定着、増殖の制御に関与すると考えられている。さまざまなB細胞によって産生されるIgAのバランスにより、全体的なIgAに結合する腸内細菌のバランスも規定されると考えられる。
[2] 病原性片利共生細菌
宿主と共生する細菌のうち、特定の環境下でのみ宿主に悪影響を与え得るもの。大腸菌などが挙げられる。
[3] 菌体成分
細菌を構成する成分であり、免疫細胞を活性化する作用を持つ。代表的なものに、細胞壁の成分であるリポ多糖やリポタイコ酸、また、鞭毛の成分であるフラジェリンなどが挙げられる。
[4] CD4陽性T細胞
CD4を発現するT細胞であり、一般的にヘルパーT細胞と呼ばれる。サイトカインを産生することでB細胞の活性化をサポートするほか、さまざまな免疫機能の活性化に関与しており、免疫司令塔として働く。
[5] 短鎖脂肪酸
一般に、炭素数6以下の直鎖状の脂肪酸を指す。腸内細菌が産生する主要な有機酸。酢酸、プロピオン酸、酪酸など。過去の研究により、免疫システムへのさまざまな効果が知られている。
[6] IgAシークエンシング
蛍光色素でラベルしたIgAとの結合を調べることで、IgAに結合する細菌と結合していない細菌を判別できる。これらの細菌を、フローサイトメトリーなど蛍光色素を解析できる機器で別個に回収し、次世代シークエンサーを用いてそれぞれの腸内細菌叢を解析する手法。
[7] 無菌マウス
腸内細菌や皮膚表面などの常在細菌が全く存在しないマウス。動物は子宮内では無菌状態であることから、帝王切開により無菌的に子マウスを取り出し、無菌アイソレーターと呼ばれる内部を無菌に保持できる特殊な飼育装置に無菌操作により搬入し、飼育することで得られる。
[8] AID欠損マウス
活性化誘導シチジンデアミナーゼ(AID)を遺伝子組換えにより欠損させたマウス。AIDは抗体のクラススイッチおよび体細胞超変異に必須であり、AID欠損マウスではIgA、IgE、IgGなどクラススイッチによって産生される抗体が見られない。
[9] 緑色蛍光陽性大腸菌
オワンクラゲから同定された緑色蛍光タンパク質を発現する大腸菌。同大腸菌をマウスに投与することで、腸管内での局在を画像的に解析可能であり、さらに、フローサイトメトリーなど蛍光色素を解析する機器で定量も可能である。
[10] T細胞依存性IgA産生、B細胞
T細胞依存性IgA産生とは、IgA産生経路のうちCD4陽性T細胞の介在を必要とするもの。CD4陽性T細胞が抗原提示を受けることで活性化し、続いてその情報をB細胞に伝達することでB細胞が活性化する。抗体産生機能を担うB細胞は、活性化することでより効果的に抗体を分泌する形質細胞に分化していく。一般的に、T細胞依存性IgA産生により、高親和性のIgAが産生されると考えられている。一方、T細胞非依存性IgA産生の経路も存在しており、その場合はB細胞が樹状細胞など他の細胞からの刺激により活性化する。
[11] Toll様受容体
リポ多糖など菌体成分の受容体であり、菌体成分のパターンを認識して免疫細胞を活性化させる。その受容体のシグナルを伝達する分子がMyD88とTRIFである。MyD88、TRIFともに欠損したマウスでは、Toll様受容体のシグナルが伝達されないため、全てのToll様受容体の機能が失われている。
6.発表者・機関窓口
<発表者> ※研究内容については発表者にお問い合わせください。
理化学研究所 生命医科学研究センター 粘膜システムチーム
研修生竹内 直志(たけうち ただし)
チームリーダー大野 博司(おおの ひろし)
TEL:045-503-9111(大野) FAX:045-503-9113
E-mail:hiroshi.ohno [at]riken.jp(大野)
竹内 直志
理化学研究所
株式会社ダイセル
日本医療研究開発機構
理化学研究所(理研)生命医科学センター粘膜システム研究チームの竹内直志研修生、大野博司チームリーダーらの国際共同研究グループ※は、腸内細菌の主要な代謝物である「酢酸」が「免疫グロブリンA(IgA)[1]」の細菌反応性を変化させることで腸内細菌の制御に関与することを発見しました。
本研究成果は、腸内細菌がその代謝物を介してIgAの機能制御に重要な役割を果たしていることを示しており、今後、IgAの機能制御に関する理解を進めることで、腸内細菌の新しい制御法の開発につながるものと期待できます。
IgAは腸内細菌を標的とする主要な免疫グロブリンですが、IgAと腸内細菌の相互作用がどのように制御されているかは明らかになっていませんでした。
今回、国際共同研究グループは、酢酸によって誘導されるIgAが大腸菌などの病原性片利共生細菌[2]に結合し、大腸表面の粘液層への侵入を阻止することを明らかにしました。また、その作用機序として、酢酸が菌体成分[3]とともにIgA産生をサポートするCD4陽性T細胞[4]の機能を強化することで、大腸菌反応性のIgAを増加させることも明らかにしました。免疫システムは腸内細菌代謝物の刺激によってIgA産生のパターンを変化させることで、腸内細菌を制御しているものと考えられます。
本研究は、科学雑誌『Nature』オンライン版(7月14日付:日本時間7月15日)に掲載されます。
※国際共同研究グループ
理化学研究所 生命医科学研究センター
粘膜システム研究チーム
チームリーダー 大野 博司 (おおの ひろし)
研修生/研究パートタイマーⅠ 竹内 直志 (たけうち ただし)
研究員 宮内 栄治 (みやうち えいじ)
上級研究員 金谷 高史 (かなや たかし)
研究員 加藤 完 (かとう たもつ)
研究員 中西 裕美子(なかにし ゆみこ)
客員研究員 對田 尚 (たいだ たかし)
基礎科学特別研究員 佐々木 崇晴(ささき たかはる)
大学院生(研究当時) 根岸 紘生 (ねぎし ひろき)
統合ゲノミクス研究チーム
チームリーダー(研究当時) 小原 收 (おはら おさむ)
上級研究員(研究当時) 渡辺 貴志 (わたなべ たかし)
代謝ネットワーク研究チーム
チームリーダー 北見 俊守 (きたみ としもり)
株式会社ダイセル
事業創出本部 事業創出センター
主席部員 島本 周 (しまもと しゅう)
ヘルスケアSBU 事業推進室 事業戦略グループ
アドバイザー 松山 彰収 (まつやま あきのぶ)
京都大学大学院 生命科学研究科 生体システム学
教授 木村 郁夫 (きむら いくお)
エモリー大学 医学部 病理学教室
教授 イフォー・ウィリアムズ(Ifor R. Williams)
研究支援
本研究は、理化学研究所共生生物学プロジェクト、日本学術振興会(JSPS)科学研究費補助金若手研究(B)「腸内細菌による中枢神経系炎症制御メカニズムの解析(研究代表者:宮内栄治)」、および日本医療研究開発機構(AMED) 革新的先端研究開発支援事業(AMED-CREST)『疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出』研究開発領域(研究開発総括:清水 孝雄)における研究開発課題名「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築(研究開発代表者:大野博司)」による支援を受けて行われました。
1.背景
私たちヒトの腸管には40兆にも及ぶ細菌が生息しており、それらは腸内細菌と呼ばれています。腸内細菌はヒトに不可欠な栄養素を産生したり、外来の病原菌を排除したりすることで、ヒトの健康維持に貢献しています。一方、過剰な細菌を制御できなければ、細菌の体内移行に伴う感染症が引き起こされる可能性もあることから、腸内細菌の制御機構の解明は細菌との共生関係において重要な課題です。さらに近年、腸内細菌が中枢神経や肥満・糖尿病などのさまざまな全身疾患に関与することが明らかになっており、腸内細菌を制御することで疾患の感受性を変化させられる可能性も示されています。
「免疫グロブリンA(IgA)」はヒト体内で最も多く産生される免疫グロブリンであり、主に腸管などの粘膜面から分泌されます。IgAは腸内細菌に結合することで、腸内細菌の増殖・定着・機能を制御していると考えられています。しかし、ダイナミックに変化する腸内環境に対応して、腸内細菌に対するIgAの反応性がどのように調節されるかは分かっていませんでした。
近年の報告から、腸内細菌が産生する代謝物が、腸管における免疫機能に大きな影響を与えていることが判明しつつあります。特に、腸内細菌の主要な代謝物である「短鎖脂肪酸[5]」は、制御性T細胞や自然リンパ球など多くの免疫細胞の誘導・機能の制御に関与することが知られています。IgAについても、短鎖脂肪酸がその分泌量を増加させる可能性が以前から示されていました。そこで今回は、短鎖脂肪酸がIgAの機能制御にも関与するのではないかとの仮説を立て、実験的に検証しました。
2.研究手法と成果
国際共同研究グループはまず、短鎖脂肪酸を腸管内で特異的に増加させる「短鎖脂肪酸付加セルロース」という飼料をマウスに投与し、大腸で局所的に短鎖脂肪酸の濃度を高めました。すると、短鎖脂肪酸の一種である「酢酸」を付加したセルロース(酢酸セルロース)の投与により、IgA産生細胞やIgA分泌量が増加すること、また、IgAの腸内細菌に対する結合率も増加していることが分かりました(図1)。一方、同様に他の短鎖脂肪酸であるプロピオン酸、酪酸の効果も調べましたが、IgAの量などに変化は見られませんでした。
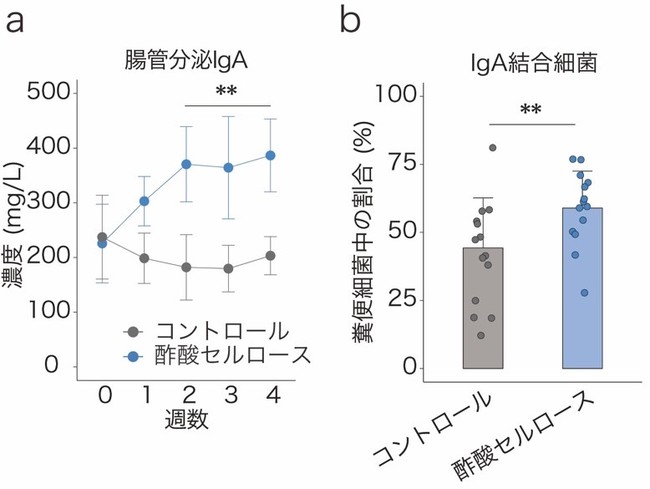
図1 酢酸によるIgA産生および腸内細菌結合率の増加
a: 酢酸セルロースの投与により、マウス糞便中の腸管分泌IgAが増加した。
b: 酢酸セルロースの投与により、マウス糞便中の細菌に対するIgAの結合率が上昇した。
**P < 0.01.
次に、IgAシークエンシング[6]を用いて、酢酸セルロース投与に伴う大腸内でのIgA結合細菌のパターン変化を調べました。その結果、コントロールマウスのIgAはBacteroidales目など一般的な共生細菌に多く結合する一方、酢酸セルロース投与マウスのIgAはEnterobacterales目に属する大腸菌など病原性片利共生細菌に結合することが明らかになりました(図2)。
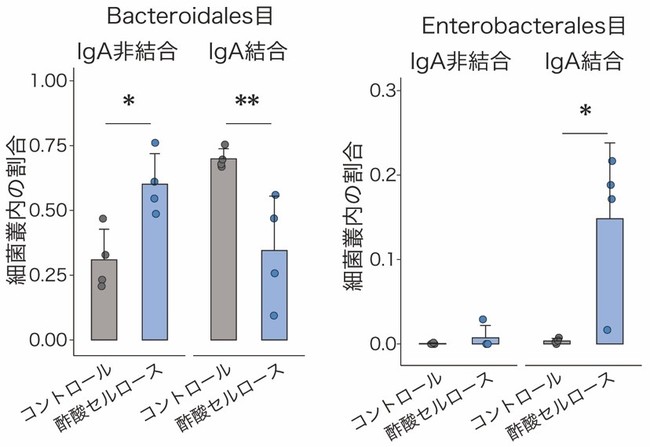
図2 酢酸によるIgA結合細菌パターンの変化
左: 一般的な共生細菌であるBacteroidales目へのIgA非結合とIgA結合の割合。IgA結合の割合は、酢酸セルロース投与マウスよりもコントロールマウスの方が高かった。
右: 大腸菌など病原性片利共生細菌であるEnterobacterales目へのIgA非結合とIgA結合の割合。IgA結合の割合は、コントロールマウスよりも酢酸セルロース投与マウスの方が高かった。
*P < 0.05、**P < 0.01.
このIgAシークエンシングの結果を検証するために、無菌マウス[7]に大腸菌(E. coli)もしくは一般的な共生細菌のBacteroides thetaiotaomicron(B. theta)をそれぞれ腸管内に定着させたマウスを作製し、酢酸セルロース投与の効果を調べました。すると、大腸菌定着マウスにおいてのみ、大腸内のIgAが増加することが分かりました(図3a)。また、加熱殺菌処理した大腸菌を無菌マウスに投与した際にも、IgAが増加しました(図3b)。以上の結果から、酢酸セルロースのIgAに対する効果は腸内細菌を構成している菌体成分に依存的であり、特に病原性片利共生細菌に対してIgAを産生させることが分かりました。
a: B. theta定着マウスでは、コントロールと酢酸セルロース投与によるIgA反応性に差は見られなかったが(左)、大腸菌(E. coli)定着マウスでは、酢酸セルロース投与によりIgA反応性が増加した(右)。
b: 加熱殺菌処理B. thetaを投与した無菌マウスでは、コントロールと酢酸セルロース投与によるIgA産生の差は見られなかったが、加熱殺菌処理大腸菌(E. coli)を投与した無菌マウスでは、酢酸セルロース投与によりIgA産生が増加した。
*P < 0.05、**P < 0.01.
次に、酢酸セルロースによって大腸で増加するIgAの腸管内での機能を調べました。酢酸セルロースにより野生型マウスでは、特に大腸表面の粘液層の腸内細菌組成が変化したのに対して、IgAを産生できなくしたAID欠損マウス[8]では酢酸セルロースを投与しても、粘液層の腸内細菌組成は変化しませんでした。
また、マウスに緑色蛍光陽性大腸菌[9]を投与したところ、酢酸セルロースにより増加したIgAは大腸菌に結合し、特に粘液層への侵入を阻止していることが分かりました(図4)。以上の結果から、酢酸セルロースによって誘導される大腸内のIgAは、粘液層における病原性片利共生細菌の定着・侵入を阻止することが明らかになりました。
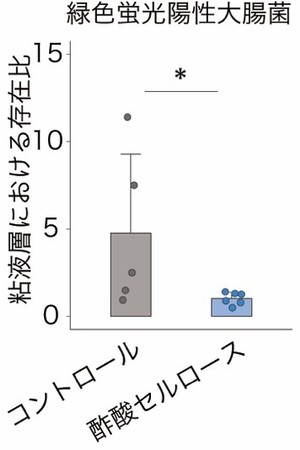
図4 酢酸とIgAによる大腸菌の粘液層侵入に対する効果
酢酸セルロース投与により、大腸粘液層における緑色蛍光陽性大腸菌の相対的な存在量が減少した。
*P < 0.05.
最後に、酢酸セルロースが特定の細菌に対してIgAを誘導する作用機序を調べました。IgA産生には、CD4陽性T細胞のサポートを必要とする経路(T細胞依存性IgA産生[10])と必要としない経路(T細胞非依存性IgA産生)の2種類があります。そこで、まず試験管内でB細胞[10]に酢酸ナトリウムと加熱処理した大腸菌(E. coli)またはB. thetaを添加し、CD4陽性T細胞とともに培養しました。その結果、酢酸と大腸菌の刺激によりIgA産生細胞が増加することが分かりました(図5a)。一方、酢酸はB. thetaとの共刺激では、IgA産生細胞を増加させませんでした(図5a)。
次に、菌体成分の受容体であるToll様受容体[11]を欠損するMyD88・TRIF二重欠損マウスを用いて、菌体成分によるCD4陽性T細胞に対する刺激がIgA産生に影響するかどうかを検証しました。T細胞を持たないCD3ε欠損マウスに、野生型マウスとMyD88・TRIF二重欠損マウスから採取したCD4陽性T細胞を移植し、それらのマウスに酢酸セルロースを投与しました。その結果、野生型マウス由来のCD4陽性T細胞を持つマウスでは、これまでの結果同様に、酢酸セルロース投与によるIgA産生の増加および大腸菌反応性IgAの増加が見られましたが、MyD88・TRIF二重欠損マウス由来のCD4陽性T細胞を持つマウスではIgA産生に差が見られませんでした(図5b)。
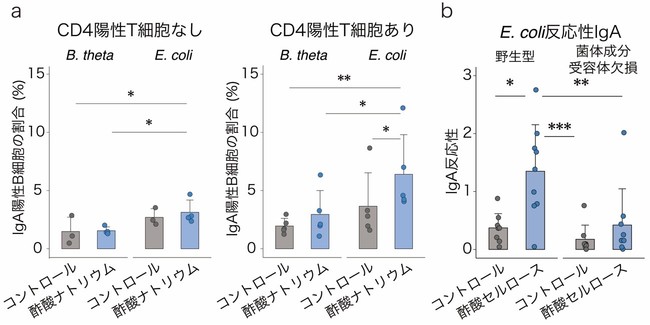
図5 酢酸と菌体成分によるCD4陽性T細胞を介したIgA反応性の変化
a: 酢酸ナトリウムと加熱処理した大腸菌(E. coli)は、CD4陽性T細胞依存的にIgA産生B細胞を増加させるが、酢酸ナトリウムと加熱処理したB. thetaiotaomicron(B. theta)の共刺激では変化が見られなかった。
b: 酢酸セルロース投与により、野生型マウス由来CD4陽性T細胞の移植マウスでは、大腸菌(E. coli)反応性IgAが増加した。一方、MyD88/TRIF二重欠損マウス由来CD4陽性T細胞の移植マウスでは大腸菌(E. coli)反応性IgAは変化しなかった。
*P < 0.05、**P < 0.01、***P < 0.001.
以上の結果から、酢酸は菌体成分とともにCD4陽性T細胞を刺激することで、T細胞依存的に大腸菌反応性のIgA産生を増加させることが明らかになりました(図6)。
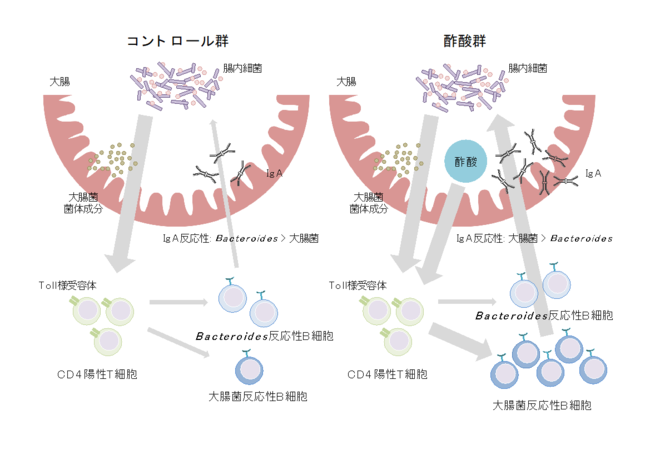
腸内細菌の代謝物である酢酸は、大腸菌の菌体成分とともにCD4陽性T細胞の機能を強化することでT細胞依存性IgA産生を増加させ、結果として腸内細菌に対するIgA反応性のバランスを変化させる。酢酸は特に大腸菌などの特定の病原性片利共生細菌に対してIgA産生を増加させる。
3.今後の期待
これまでの報告から、同じ細菌種であっても特定の環境下ではIgAに結合したり結合しなかったりすることが示唆されていましたが、なぜIgAと腸内細菌の相互作用が変化するのか、どのように制御されているのか、明らかになっていませんでした。本研究では、腸内細菌の代謝物である酢酸が腸内細菌の菌体成分とともにT細胞依存的IgA産生を増強することでIgAのバランスを変化させること、酢酸が特に病原性片利共生細菌へのIgA産生を増加させることで細菌の腸管内局在性に影響を与えることが明らかになりました。
腸内細菌は消化管だけではなく、中枢神経や肥満・糖尿病など、さまざまな疾患に関与することが明らかになっています。そのため、腸内細菌を制御することが、新しい治療法につながると考えられています。IgAは腸内細菌を制御する主要な免疫システムであり、IgAと腸内細菌の相互作用を理解していくことで、将来的に腸内細菌制御と疾患の予防・治療につながることが期待できます。
4.論文情報
<タイトル>
Acetate differentially regulates IgA reactivity to commensal bacteria
<著者名>
Tadashi Takeuchi, Eiji Miyauchi, Takashi Kanaya, Tamotsu Kato, Yumiko Nakanishi, Takashi Watanabe, Toshimori Kitami, Takashi Taida, Takaharu Sasaki, Hiroki Negishi, Shu Shimamoto, Akinobu Matsuyama, Ikuo Kimura, Ifor R. Williams, Osamu Ohara, Hiroshi Ohno
<雑誌>
Nature
<DOI>
10.1038/s41586-021-03727-5
5.補足説明
[1] 免疫グロブリンA(IgA)
B細胞によって産生される免疫グロブリンは、M、D、G、E、Aの五つのクラスに分類される。そのうち、IgAは生体内で最も多く産生される免疫グロブリンであり、主に腸管などの粘膜面から分泌される。IgAは腸内細菌と結合することで、腸内細菌の侵入、定着、増殖の制御に関与すると考えられている。さまざまなB細胞によって産生されるIgAのバランスにより、全体的なIgAに結合する腸内細菌のバランスも規定されると考えられる。
[2] 病原性片利共生細菌
宿主と共生する細菌のうち、特定の環境下でのみ宿主に悪影響を与え得るもの。大腸菌などが挙げられる。
[3] 菌体成分
細菌を構成する成分であり、免疫細胞を活性化する作用を持つ。代表的なものに、細胞壁の成分であるリポ多糖やリポタイコ酸、また、鞭毛の成分であるフラジェリンなどが挙げられる。
[4] CD4陽性T細胞
CD4を発現するT細胞であり、一般的にヘルパーT細胞と呼ばれる。サイトカインを産生することでB細胞の活性化をサポートするほか、さまざまな免疫機能の活性化に関与しており、免疫司令塔として働く。
[5] 短鎖脂肪酸
一般に、炭素数6以下の直鎖状の脂肪酸を指す。腸内細菌が産生する主要な有機酸。酢酸、プロピオン酸、酪酸など。過去の研究により、免疫システムへのさまざまな効果が知られている。
[6] IgAシークエンシング
蛍光色素でラベルしたIgAとの結合を調べることで、IgAに結合する細菌と結合していない細菌を判別できる。これらの細菌を、フローサイトメトリーなど蛍光色素を解析できる機器で別個に回収し、次世代シークエンサーを用いてそれぞれの腸内細菌叢を解析する手法。
[7] 無菌マウス
腸内細菌や皮膚表面などの常在細菌が全く存在しないマウス。動物は子宮内では無菌状態であることから、帝王切開により無菌的に子マウスを取り出し、無菌アイソレーターと呼ばれる内部を無菌に保持できる特殊な飼育装置に無菌操作により搬入し、飼育することで得られる。
[8] AID欠損マウス
活性化誘導シチジンデアミナーゼ(AID)を遺伝子組換えにより欠損させたマウス。AIDは抗体のクラススイッチおよび体細胞超変異に必須であり、AID欠損マウスではIgA、IgE、IgGなどクラススイッチによって産生される抗体が見られない。
[9] 緑色蛍光陽性大腸菌
オワンクラゲから同定された緑色蛍光タンパク質を発現する大腸菌。同大腸菌をマウスに投与することで、腸管内での局在を画像的に解析可能であり、さらに、フローサイトメトリーなど蛍光色素を解析する機器で定量も可能である。
[10] T細胞依存性IgA産生、B細胞
T細胞依存性IgA産生とは、IgA産生経路のうちCD4陽性T細胞の介在を必要とするもの。CD4陽性T細胞が抗原提示を受けることで活性化し、続いてその情報をB細胞に伝達することでB細胞が活性化する。抗体産生機能を担うB細胞は、活性化することでより効果的に抗体を分泌する形質細胞に分化していく。一般的に、T細胞依存性IgA産生により、高親和性のIgAが産生されると考えられている。一方、T細胞非依存性IgA産生の経路も存在しており、その場合はB細胞が樹状細胞など他の細胞からの刺激により活性化する。
[11] Toll様受容体
リポ多糖など菌体成分の受容体であり、菌体成分のパターンを認識して免疫細胞を活性化させる。その受容体のシグナルを伝達する分子がMyD88とTRIFである。MyD88、TRIFともに欠損したマウスでは、Toll様受容体のシグナルが伝達されないため、全てのToll様受容体の機能が失われている。
6.発表者・機関窓口
<発表者> ※研究内容については発表者にお問い合わせください。
理化学研究所 生命医科学研究センター 粘膜システムチーム
研修生竹内 直志(たけうち ただし)
チームリーダー大野 博司(おおの ひろし)
TEL:045-503-9111(大野) FAX:045-503-9113
E-mail:hiroshi.ohno [at]riken.jp(大野)

竹内 直志

このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
- 種類
- その他
- ビジネスカテゴリ
- 化学フィットネス・ヘルスケア
- ダウンロード
