マウスは進化の過程で遺伝子治療薬として働くRNAを獲得していたことを解明
~ヒトの遺伝病を治療できる人工RNAの開発に期待~
本研究成果は、日本時間2023年12月14日(木)午前1時公開のMolecular Cell誌に掲載されました。
ポイント
・マウスは自身のRNAを遺伝子治療薬のように使い多数の遺伝子変異を無毒化していることを発見。
・このRNAは遺伝子変異となる部分をmRNAに取り込まれないようにすることで無毒化を実現。
・この仕組みを利用してヒトの遺伝病の異常エクソンを長期に渡って無毒化することが可能。
概要
北海道大学大学院薬学研究院の中川真一教授と摂南大学の芳本 玲講師らの研究グループは、発見以来40年以上、機能が不明だったマウスのRNA(4.5SH RNA)の、新たな役割を発見しました。
マウスのゲノムDNAには正常なmRNA*1を作る上で不具合となり得る配列が多数存在しています。それらがmRNAに取り込まれると致死性の遺伝病の原因となりますが、4.5SH RNAにはそれらを一括して無毒化する、解毒剤のような働きがありました。つまり、マウスは進化の過程で、いわば天然の遺伝子治療薬を獲得していたことになります。更に、4.5SH RNAは二つのモジュールから構成されていることも分かりました。一つは異常な配列を見つけるためのセンサーの役割を、もう一つは異常な配列がmRNAに取り込まれないようにするためのツールを連れてくる役割を果たしています。この発見は、このセンサー部分を変更することにより、特定の遺伝子変異のみを認識する新しい遺伝子治療薬を開発できる可能性を示唆しています。これが実現すれば、遺伝病を引き起こす変異を長期的に無毒化する新しい遺伝子治療の道が開かれるかもしれません。
なお、本研究成果は、日本時間2023年12月14日(木)午前1時公開のMolecular Cell誌に掲載されました。
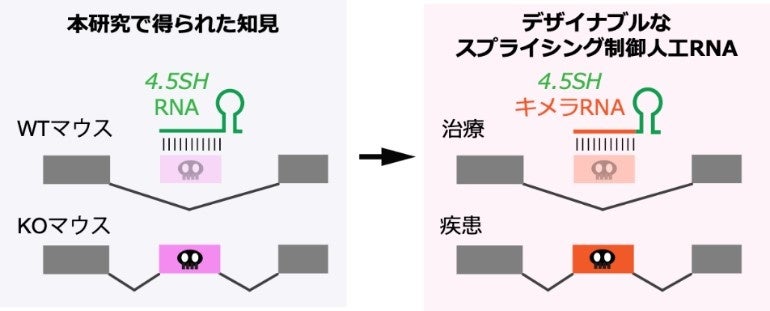
mRNAの情報はゲノムDNAに分断されて書き込まれており、それらがつなぎ合わされることで正常なmRNAが完成する。4.5SH RNAは、mRNAに取り込まれると不具合を起こす異常な配列(紫色)を認識し、mRNAへの取り込みを防ぐことで無毒化する。この仕組みを応用すると、遺伝病の原因となる変異(橙色)のmRNAへの取り込みを防ぐ遺伝子治療薬の作製が可能となる。
【背景】
ゲノムDNAに書き込まれた遺伝情報はmRNAへと転写され、このmRNAがさらにタンパク質に翻訳されることで、私たちの体の様々な機能を支えています。通常、mRNAの情報はゲノムDNAの中に分断して書き込まれており、それらが正確につなぎ合わされることで、初めて意味のあるmRNAが作られます。この過程で誤った配列が取り込まれてしまうと、正しいmRNAが作られず、そのような異常が原因となる遺伝的な疾患も数多く知られています。
一般に、ゲノムの中にはレトロトランスポゾン*2と呼ばれる動く遺伝子が存在し、進化の過程でゲノムDNAの様々な場所にそのコピーが挿入されています。マウスにおいては、特にSINE B1と呼ばれるレトロトランスポゾンの配列が、非常に数多く挿入されています。奇妙なことに、SINE B1の挿入配列の一部は、mRNAをつなぎ合わせる過程で誤ってmRNAに取り込まれてしまうような目印を持っているにもかかわらず、実際にはほとんど取り込まれません。いわば、マウスはmRNAに取り込まれると遺伝病の原因となり得る配列を多数持っているにもかかわらず、何らかのメカニズムでそれを回避しているのです。いったいマウスはどのようにして、遺伝病にならずに健康でいられるのでしょうか。
【研究手法】
ゲノムから転写されたRNAの中には、タンパク質に翻訳されずにそのままRNAとして機能するものが存在しており、それらは一括してノンコーディングRNAと呼ばれています。ヒトやマウスなどの生物からは数万種類のノンコーディングRNAが見つかっていますが、その多くは依然として役割や機能が不明であり、これを解き明かすことは分子生物学における大きな挑戦となっています。4.5SH RNAは、マウスやラット、ハムスターといった小型のげっ歯類にのみ見られるノンコーディングRNAで、1980年に本邦の研究者である原田文夫博士によって配列が明らかにされましたが、その機能は40年以上もの間、不明のままでした。研究グループは、近年発展著しいゲノム編集技術を取り入れ、4.5SH RNAを含むゲノム領域が欠けているマウスを作製し、4.5SH RNAを持たないノックアウト(KO)マウスが着床直後に死んでしまうことを明らかにしました。また、4.5SH RNAは、mRNAをつなぎ合わせる際に必要な因子が濃縮している、核スペックルという領域に多く存在することから(図1)、mRNAのつなぎ合わせに異常が見られるかどうかを、RNAシークエンシングと呼ばれる手法で解析しました。
【研究成果】
4.5SH KO細胞のRNAシークエンシングの結果から、KOマウスのmRNAには、野生型マウスのmRNAでは決して見られない異常な配列が、多数取り込まれていることが分かりました(図2A)。これらの異常な配列は、取り込まれたmRNAに変異を導入し、その遺伝子の機能を破壊してしまいます。次に、これらの異常な配列に共通の性質があるかどうかを調べたところ、その多くが4.5SH RNAとペアを作る*3ような配列をもつ、レトロトランスポゾンSINE B1の挿入配列であることが分かりました(図2B)。SINE B1は挿入される方向と部位によってはmRNAをつなぎ合わせる際に必要な配列を生じるため、4.5SH RNAが存在しない状況では、mRNAに取り込まれて遺伝病の原因となるような変異を導入してしまいます。ところが、4.5SH RNAはそのような配列を認識してペアを作り、mRNAへの取り込みを強力に抑制することで、正常なmRNAができるのを助けていました。つまり、マウスは致死性の遺伝病となるような異常配列を多数持っているものの、それらを一括して治療できる解毒剤のような遺伝子を進化の過程で獲得したために生きながらえることができた、ということになります。
さらに本研究では、4.5SH RNAがSINE B1の挿入配列を排除する詳細な分子メカニズムを明らかにするために、分子生物学的な解析を行いました。その結果、4.5SH RNAは、SINE B1の挿入配列を見分けるセンサーのような役割を持つモジュールと、mRNAへの取り込みを防ぐツールを連れてくるモジュールとに分かれていることが判明しました(図3)。非常に興味深いことに、このセンサー部分を別の配列と入れ替えることで、任意の配列のmRNAへの取り込みを抑制する人工的なキメラRNA分子を作製可能であることも分かりました。
【今後への期待】
今回の研究によって、進化の過程で生まれた、遺伝病の原因となり得るレトロトランスポゾン由来の配列に対して、マウスがどのように対処してきたのか、その一端を明らかにすることができました。SINE B1は、mRNAの中に取り込まれて致死性の変異を生み出し得る、大変危険な存在です。実際、類似の配列がmRNAに取り込まれることが原因となる、ヒトの遺伝病も複数知られています。この問題に対抗するために、マウスは、4.5SH RNAという特別なRNAを使っています。いわば、マウスは4.5SH RNAという遺伝子治療薬を自ら作り出すことで、遺伝病になるのを防いでいたのです。
研究グループは、この驚くべき自己防衛メカニズムを、ヒトの遺伝病治療に応用できるのではないかと期待しています。実際、異常配列をmRNAに取り込まれないようにすることで治療が可能な遺伝病が存在しており、現在、そのような活性を持つアンチセンス核酸と呼ばれる核酸医薬よる治療が注目を集めています。しかしながら、核酸医薬は合成にコストがかかるうえ、頻繁な維持投与が必要となり、患者さんへの負担も大きくなります。今回、研究グループが開発したキメラRNAは遺伝子治療用のウイルスベクターを用いて細胞自身に作らせることが可能であり、アンチセンス核酸と比較して長期に渡る効果が期待できます。今後、動物モデルを用いて、我々のキメラ分子が個体レベルで遺伝性疾患の治療に使えるかどうかを検証してゆく予定です。
【謝辞】
本研究は、文部科学省学術変革領域研究(A)「非ドメイン型バイオポリマーの生物学」における研究課題「マウス変異体を用いた非ドメイン型RNAの生理機能解析」(研究代表者:中川真一)、ならびに国⽴研究開発法⼈⽇本医療研究開発機構(AMED)橋渡し研究戦略的推進プログラムにおける研究開発課題「任意のエクソンのスキッピングを誘導する人工RNAの開発」 (シーズ A_北海道⼤学拠点_研究開発代表者:中川真一)の⼀環として⾏われました。
論文情報
論文名
4.5SH RNA counteracts deleterious exonization of SINE B1 in mice(4.5SH RNA はマウスにおいてSINE B1 の有害なエクソン化と拮抗している)
著者名
芳本 玲1、中山雄太2、野村郁子2、山本育子2、中川夢花1、田中茂幸1、栗原美寿々2、鈴木 雄3、小林武彦3、小塚-秦 裕子4、尾山大明4、水戸麻理5、岩崎信太郎5,6、山崎智弘7、廣瀬哲郎7,8、荒木喜美9, 10、中川真一2(1摂南大学農学部応用生物科学科、2北海道大学大学院薬学研究院、3東京大学定量生命科学研究所、4東京大学医科学研究所、5理化学研究所開拓研究本部、6東京大学大学院新領域創成科学研究科、7大阪大学生命機能研究科、8大阪大学先導的学際研究機構、9熊本大学生命科学研究部附属健康長寿代謝制御研究センター、10熊本大学生命資源研究・支援センター)
雑誌名 Molecular Cell(分子生物学の専門誌)
DOI 10.1016/j.molcel.2023.11.019
公表日 日本時間2023年12月14日(木)午前1時(米国東部時間2023年12月13日(水)午前11時)(オンライン公開)
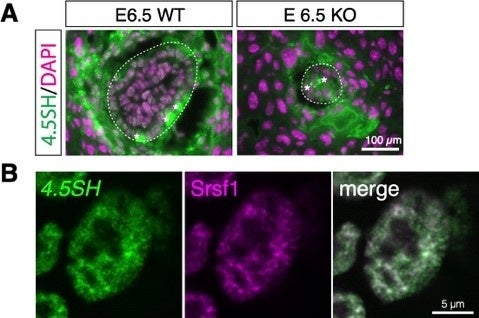
図1. 4.5SH KOマウスの発現と表現型。(A)4.5SH KOマウスの表現型。胎生6.5日(E6.5)目には野生型(WT)と比較すると胚の発育が著しく遅れ、致死となる。点線は胚の外縁。星印は自家蛍光のシグナルを示す。(B)ES細胞における4.5SH RNAの局在をin situハイブリダイゼーションで可視化したもの(緑)。mRNAをつなぎ合わせる過程に関わるSrsf1(紫)が局在する核スペックルへの局在が観察される。
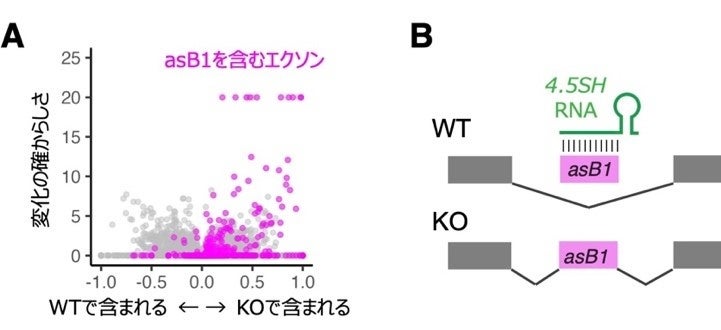
図2. 4.5SH KO細胞でのmRNAのつなぎ合わせの異常。(A)4.5SH KO細胞でmRNAに取り込まれた異常配列のプロット。KO細胞では野生型(WT)で見られない配列が多数mRNAに取り込まれておりその多くはSINE B1が逆方向に挿入された配列(asB1)を持っている。(B) 4.5SH KO細胞で見られるmRNAのつなぎ合わせの異常。4.5SHはasB1とペアを形成し、mRNAへの取り込みを強力に抑制する。asB1の多くは致死性の変異を導入するため、4.5SH RNAのKOマウスは致死となる。

図3. 4.5SH RNAのモジュール構造とmRNAへの異常配列の取り込みを防ぐキメラ分子。(A)4.5SH RNAのモジュール構造。5'側に存在するステムループ構造はmRNAのつなぎ合わせを阻害するツールとして働くHnrnpm、Sfpq、Nonoなどの分子と結合し、3'側は標的エクソンを認識してペアを形成する。(B)任意のエクソンのスキッピングを誘導する人工キメラ分子の作製例。4.5SH RNAの標的認識配列を任意のエクソンの相補的な配列に置き換えることでエクソンスキッピングを誘導するキメラRNAを作製できる。
【用語解説】
*1 mRNA … タンパク質を作るための情報を運ぶ分子。ゲノムDNAから転写されて作られる。mRNAとなる部分はゲノムDNA上では分断して存在しており、それらがつなぎ合わされることで成熟したmRNAが作られる。
*2 レトロトランスポゾン … ヒトのゲノムの中を飛び回ることができる特別な配列の一つ。レトロトランスポゾンが飛び回ることで、時には我々の遺伝物質に変化をもたらし、進化や遺伝病の原因となることがある。SINE B1はげっ歯類で特にコピー数を増やしたレトロトランスポゾンであり、マウスでは実にゲノムの1割以上を占め、イントロンにアンチセンス方向*4に挿入された配列は異常なエクソンとして認識されやすいという性質を持つ。
*3 ペアを作る配列 … RNAの鎖は、A(アデニン)、U(ウラシル)、C(シトシン)、G(グアニン)という4種類の「文字」から成り立つ。これらの文字は特定のルールに従ってペアを作ることができる。例えば、AはUとペアを作り、CはGとペアを作る。つまり、RNAの一本の鎖に対して、相補的な配列を持つ鎖は、ペアを作ることができる。
*4 アンチセンス方向 … 二本のRNAの鎖がペアを作っているとき、片方の鎖をセンス鎖、ペアを作る「相補的な」配列を持つ鎖をアンチセンスと呼ぶ。例えば、AUCGという配列がセンス方向に挿入された場合はAUCGという鎖は、A(アデニン)、U(ウラシル)、C(シトシン)、G(グアニン)という4種類の「文字」から成り立つ。これらの文字は特定のルールに従ってペアを作ることができる。例えば、AはUとペアを作り、CはGとペアを作る。つまり、RNAの一本の鎖に対して、相補的な配列を持つ鎖は、ペアを作ることができる。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
