糖尿病モデルマウスの血糖値改善に成功
~ 効率的なインスリン産生細胞作製法を開発 ~
順天堂大学大学院医学研究科代謝内分泌内科学の三浦 正樹助手、宮塚 健准教授、綿田 裕孝教授らの研究グループは、転写因子STAT3(*1)シグナルが、膵前駆細胞(*2)や腺房細胞(*3)からインスリン産生細胞であるβ細胞(*4)へのリプログラミング(*5)を制御することを見出しました。さらに、STAT3阻害薬を用いて糖尿病モデルマウスの血糖値を改善することに成功しました。本研究はSTAT3を標的とした新たなβ細胞作製法の開発につながる可能性があり、糖尿病再生医療への応用が期待されます。本研究成果は英国科学雑誌「EbioMedicine」オンライン版に2018年9月25日付で公開されました。
【本研究成果のポイント】
【背景】
糖尿病は膵β細胞から分泌されるインスリンの相対的・絶対的不足により発症します。よって糖尿病の根治を実現するためには失われたインスリン分泌を補う必要があり、インスリン産生細胞であるβ細胞を補充する糖尿病再生医療が注目されています。膵前駆細胞や腺房細胞はβ細胞と同じ発生学的起源を持ち、β細胞へと分化転換する可塑性のある細胞です。以前、研究グループはヒトやマウスの腺房細胞から膵管様細胞への分化転換において転写因子STAT3の活性化が不可欠であることを見出しました。このことから、膵前駆細胞や腺房細胞からβ細胞へのリプログラミング過程においてSTAT3の活性化が何らかの役割を担っているのではないかと考え、これを検証するために、マウス膵前駆細胞株および遺伝子改変マウスを用いて実験を行いました。
【内容】
まず、研究グループは、マウス膵前駆細胞株(mPAC細胞)を用いてリプログラミング過程におけるSTAT3活性化の役割を検討しました。はじめに、転写因子Pdx1 (*6) またはMafa (*7) をmPAC細胞に発現させるとSTAT3の活性化(リン酸化)がみられました。次に、3つの転写因子Pdx1、Neurog3 (*8) 、Mafaを同時に mPAC細胞に発現させると、β細胞新生が誘導されましたが、β細胞では STAT3の活性化は抑制されていました。このことから、3つの転写因子が発現した細胞において、STAT3シグナルを抑制することがβ細胞新生を誘導するという仮説を立てました。そこで、Pdx1、Neurog3、Mafaを発現させたmPAC細胞においてアデノウイルスやSTAT3阻害薬を用いてSTAT3シグナルを抑制したところ、β細胞数が増加し、反対にSTAT3を恒常的に活性化させるとβ細胞数は減少しました。これらの結果は、STAT3シグナルの活性化がβ細胞へのリプログラミングを負に制御することを示唆しています。
次に、生体内における STAT3の役割を検討するために、β細胞新生モデルマウスにおいて Stat3 遺伝子を欠失させたところ、 Stat3欠失マウスの膵臓では新生β細胞数が増加し、さらに複数の新生β細胞が一塊となった膵島様構造を形成することが明らかとなりました(図1)。さらに、糖尿病モデルマウスの膵臓にアデノウイルスを用いてPdx1、Neurog3、Mafaを発現させ、STAT3阻害薬(BP-1-101)を投与することにより高血糖を改善することに成功しました。
【用語解説】
(*1) STAT3
免疫系の制御、細胞の分化、増殖、細胞死といった多様な生体調節機構において重要な役割を担う転写因子。
(*2) 膵前駆細胞
膵β細胞や膵α細胞(=グルカゴン産生細胞)、あるいは膵腺房細胞のもとになる細胞。
(*3) 腺房細胞
膵臓の外分泌部に存在して消化酵素などを産生・分泌する細胞。
(*4) β 細胞
血糖値を下げるホルモンであるインスリンを分泌する細胞。糖尿病患者ではβ細胞の機能が低下、あるいはβ細胞数が減少している。
(*5) リプログラミング
ある細胞が他の機能を持った細胞へと性質を変えること。
(*6) Pdx1
膵臓の初期形成に不可欠な転写因子。成熟β細胞にも強く発現している。PDX1の遺伝子異常は糖尿病の原因の一つである。
(*7) Mafa
成熟β細胞の機能維持に不可欠な転写因子。
(*8) Neurog3
膵内分泌細胞および腸管内分泌細胞の分化に不可欠な転写因子。
【論文】
本研究成果は科学雑誌「EBioMedicine」オンライン版(2018年9月25日付)で公開されました。
論文タイトル:Suppression of STAT3 signaling promotes cellular reprogramming into insulin-producing cells induced by defined transcription factors
日本語訳:Stat3シグナルの抑制は膵内分泌細胞特異的転写因子により誘導されるインスリン産生細胞へのリプログラミングを亢進させる
著者:Masaki Miura1, Takeshi Miyatsuka1,2, Takehiro Katahira1, Shugo Sasaki3, Luka Suzuki1,Miwa Himuro1, Yuya Nishida1, Yoshio Fujitani1,4, Taka-aki Matsuoka3, and Hirotaka Watada 1,2,5,6
著者(日本語表記):三浦 正樹1、宮塚 健1,2、片平 雄大1、佐々木 周吾1、鈴木 路可1、氷室 美和1、西田 友哉1、藤谷 与士夫1,4 、松岡 孝昭3、綿田 裕孝1,2,5,6
所属:
1) 順天堂大学大学院医学研究科代謝内分泌内科学
2) 順天堂大学院医学研究科寄付講座(先進糖尿病治療学講座)
3) 大阪大学大学院医学系研究科内分泌・代謝内科学
4) 群馬大学生体調節研究所分子糖代謝制御分野
5) 順天堂大学大学院スポートロジーセンター
6) 順天堂大学大学院医学研究科寄付講座(糖尿病治療標的探索医学講座)
掲載誌: EBioMedicine (https://www.ebiomedicine.com/)
DOI: 10.1016/j.ebiom.2018.09.035
本研究は、文部科学省JSPS科研費(JP16K09766)、武田科学振興財団、鈴木謙三記念医科学応用研究財団、公益財団法人アステラス病態代謝研究会、日本糖尿病学会若手研究助成金、私立大学戦略的研究基盤形成支援事業(S1411007)、日本イーライリリー、Life Scan、ノバルティス、武田薬品工業からの研究助成を受けて行われました。
- STAT3シグナルがβ細胞へのリプログラミングを制御する新たな分子機構を解明
- STAT3シグナルを抑制することで新生β細胞数を増加させ、糖尿病モデルマウスの耐糖能を 改善させることに成功
- STAT3を標的としたβ細胞作製法の開発と糖尿病の再生医療への応用に期待
【背景】
糖尿病は膵β細胞から分泌されるインスリンの相対的・絶対的不足により発症します。よって糖尿病の根治を実現するためには失われたインスリン分泌を補う必要があり、インスリン産生細胞であるβ細胞を補充する糖尿病再生医療が注目されています。膵前駆細胞や腺房細胞はβ細胞と同じ発生学的起源を持ち、β細胞へと分化転換する可塑性のある細胞です。以前、研究グループはヒトやマウスの腺房細胞から膵管様細胞への分化転換において転写因子STAT3の活性化が不可欠であることを見出しました。このことから、膵前駆細胞や腺房細胞からβ細胞へのリプログラミング過程においてSTAT3の活性化が何らかの役割を担っているのではないかと考え、これを検証するために、マウス膵前駆細胞株および遺伝子改変マウスを用いて実験を行いました。
【内容】
まず、研究グループは、マウス膵前駆細胞株(mPAC細胞)を用いてリプログラミング過程におけるSTAT3活性化の役割を検討しました。はじめに、転写因子Pdx1 (*6) またはMafa (*7) をmPAC細胞に発現させるとSTAT3の活性化(リン酸化)がみられました。次に、3つの転写因子Pdx1、Neurog3 (*8) 、Mafaを同時に mPAC細胞に発現させると、β細胞新生が誘導されましたが、β細胞では STAT3の活性化は抑制されていました。このことから、3つの転写因子が発現した細胞において、STAT3シグナルを抑制することがβ細胞新生を誘導するという仮説を立てました。そこで、Pdx1、Neurog3、Mafaを発現させたmPAC細胞においてアデノウイルスやSTAT3阻害薬を用いてSTAT3シグナルを抑制したところ、β細胞数が増加し、反対にSTAT3を恒常的に活性化させるとβ細胞数は減少しました。これらの結果は、STAT3シグナルの活性化がβ細胞へのリプログラミングを負に制御することを示唆しています。
次に、生体内における STAT3の役割を検討するために、β細胞新生モデルマウスにおいて Stat3 遺伝子を欠失させたところ、 Stat3欠失マウスの膵臓では新生β細胞数が増加し、さらに複数の新生β細胞が一塊となった膵島様構造を形成することが明らかとなりました(図1)。さらに、糖尿病モデルマウスの膵臓にアデノウイルスを用いてPdx1、Neurog3、Mafaを発現させ、STAT3阻害薬(BP-1-101)を投与することにより高血糖を改善することに成功しました。
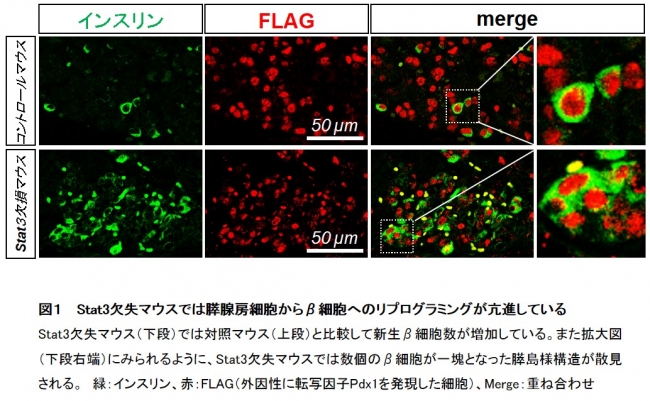 図1 Stat3欠失マウスでは膵腺房細胞からβ細胞へのリプログラミングが亢進している
図1 Stat3欠失マウスでは膵腺房細胞からβ細胞へのリプログラミングが亢進している
以上より、STAT3シグナルが非β細胞からβ細胞へのリプログラミングを負に制御するという新たな分子機構を明らかにできたことで、 STAT3シグナルの抑制によるβ細胞の新生誘導が可能になりました(図2) 。
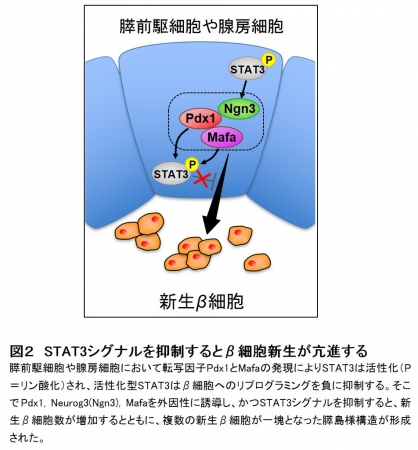 図2 STAT3シグナルを抑制するとβ細胞新生が亢進する
図2 STAT3シグナルを抑制するとβ細胞新生が亢進する
【今後の展開】
最近、STAT3遺伝子の変異が新生児糖尿病の原因となることが報告されており、ヒトの膵臓発生においてもSTAT3シグナルがβ細胞分化を制御する可能性が示唆されます。本研究で、STAT3阻害薬を投与することによりβ細胞新生を効率化し、糖尿病マウスの血糖値を改善することに成功したことで、STAT3を標的とした新たなβ細胞作製法の可能性がみえてきました。現在、STAT3阻害薬は抗悪性腫瘍薬としての臨床応用が期待されており、同薬の安全性が確立されれば、糖尿病再生医療への応用も期待できます。本研究成果をもとに、より多くのβ細胞を効率的に作製することにより、糖尿病根治に向けた新たな治療法を開発していきたいと考えています。【用語解説】
(*1) STAT3
免疫系の制御、細胞の分化、増殖、細胞死といった多様な生体調節機構において重要な役割を担う転写因子。
(*2) 膵前駆細胞
膵β細胞や膵α細胞(=グルカゴン産生細胞)、あるいは膵腺房細胞のもとになる細胞。
(*3) 腺房細胞
膵臓の外分泌部に存在して消化酵素などを産生・分泌する細胞。
(*4) β 細胞
血糖値を下げるホルモンであるインスリンを分泌する細胞。糖尿病患者ではβ細胞の機能が低下、あるいはβ細胞数が減少している。
(*5) リプログラミング
ある細胞が他の機能を持った細胞へと性質を変えること。
(*6) Pdx1
膵臓の初期形成に不可欠な転写因子。成熟β細胞にも強く発現している。PDX1の遺伝子異常は糖尿病の原因の一つである。
(*7) Mafa
成熟β細胞の機能維持に不可欠な転写因子。
(*8) Neurog3
膵内分泌細胞および腸管内分泌細胞の分化に不可欠な転写因子。
【論文】
本研究成果は科学雑誌「EBioMedicine」オンライン版(2018年9月25日付)で公開されました。
論文タイトル:Suppression of STAT3 signaling promotes cellular reprogramming into insulin-producing cells induced by defined transcription factors
日本語訳:Stat3シグナルの抑制は膵内分泌細胞特異的転写因子により誘導されるインスリン産生細胞へのリプログラミングを亢進させる
著者:Masaki Miura1, Takeshi Miyatsuka1,2, Takehiro Katahira1, Shugo Sasaki3, Luka Suzuki1,Miwa Himuro1, Yuya Nishida1, Yoshio Fujitani1,4, Taka-aki Matsuoka3, and Hirotaka Watada 1,2,5,6
著者(日本語表記):三浦 正樹1、宮塚 健1,2、片平 雄大1、佐々木 周吾1、鈴木 路可1、氷室 美和1、西田 友哉1、藤谷 与士夫1,4 、松岡 孝昭3、綿田 裕孝1,2,5,6
所属:
1) 順天堂大学大学院医学研究科代謝内分泌内科学
2) 順天堂大学院医学研究科寄付講座(先進糖尿病治療学講座)
3) 大阪大学大学院医学系研究科内分泌・代謝内科学
4) 群馬大学生体調節研究所分子糖代謝制御分野
5) 順天堂大学大学院スポートロジーセンター
6) 順天堂大学大学院医学研究科寄付講座(糖尿病治療標的探索医学講座)
掲載誌: EBioMedicine (https://www.ebiomedicine.com/)
DOI: 10.1016/j.ebiom.2018.09.035
本研究は、文部科学省JSPS科研費(JP16K09766)、武田科学振興財団、鈴木謙三記念医科学応用研究財団、公益財団法人アステラス病態代謝研究会、日本糖尿病学会若手研究助成金、私立大学戦略的研究基盤形成支援事業(S1411007)、日本イーライリリー、Life Scan、ノバルティス、武田薬品工業からの研究助成を受けて行われました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
