膵がんのKRAS/GNASドライバー変異を一挙捕捉する 6色マルチプレックスデジタルPCRの2つの高感度解析メソッド
臨床応用と社会実装への道筋
発表のポイント
-
膵がんの主要ホットスポット変異を包括的にスクリーニングする6色マルチプレックスデジタルPCRの2つのアッセイ法を構築
-
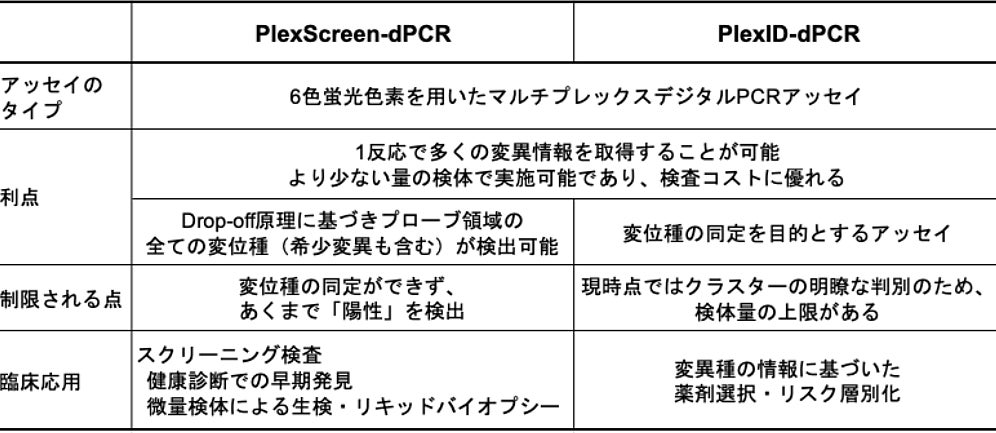
PlexScreen-dPCR法によりターゲット領域の変異を高感度に検出。PlexID-dPCR法では14種類の主要変異を1反応で同定。
-
リキッドバイオプシーや薬剤選択など、腫瘍診断への多様な臨床応用を目指す。
概要
本研究は、札幌東徳洲会病院 医学研究所と旭川医科大学、国立研究開発法人医薬基盤・健康・栄養研究所を拠点とする研究チームによる共同研究で、膵がんの発がんに関連する主要ドライバー変異(KRASおよびGNASのホットスポット変異)を、少ない反応数で包括的に検出するための6色マルチプレックスデジタルPCRアッセイ法を構築しました。PlexScreen-dPCRは、ターゲット領域の変位種を限定しないスクリーニング系で変異検出限界を0.03–0.06%(約1万分の3–6程度で存在する微量変異)まで達成し、低頻度変異を高感度で検出可能であることが実証されました。一方、PlexID-dPCRは、KRAS・GNASに関する14の一般的な変異を特異的に同定します。これらのアッセイは、大規模シーケンシングに比べて作業時間が短縮され、コスト効率の可能性が示唆されるほか、リキッドバイオプシーや断片化されたDNAサンプルでの使用にも適しています。最小限の侵襲アプローチで収集された検体での高感度な変異解析により早期診断、悪性化リスク評価、モニタリング、個別化治療を支援します。
本研究は国際学術誌Clinical Chemistry誌(Clarivate社分類Medical Laboratory Technology分野でインパクトファクター1位)にアクセプトされ、2026年1月9日にオンライン公開されました。この解析法は、腫瘍診断における新たな標準となり得ることが期待されます。
背景
膵がんは、その進行性の性質と診断の難しさから、早期発見と効果的な治療が急務とされています。近年、シーケンシング技術の占める役割はがんゲノミクス分野で飛躍的に拡大してきました。遺伝子パネルを用いて広範な領域を網羅的に解析可能である一方で、1回の検査費用、ターンアラウンドタイム(TAT)、および必要なサンプルの量・質などについては早期発見を目的とした日常的な検査において障壁となっています。これに対し、デジタルPCR(dPCR)*1は絶対定量と高感度を特徴とする定量PCR技術で、微量または断片化された核酸検体での変異検出においてもシーケンシングと比較すると低コストの反応で高い検出力を発揮します。さらに2023年に発表された6色検出dPCRシステム(QX600 Droplet Digital PCRシステム、バイオラッド社)は1度に測定できる変異ターゲットが従来の2色検出と比較して大幅に増加し、効果的なマルチプレックス解析を可能にしました。
そこで本研究グループは、膵がんの主要ドライバー変異(KRAS、GNAS遺伝子)を標的としてdPCRの利点を最大限に活かした新たな診断手法を開発しました。この取り組みは、臨床での早期発見とモニタリングを可能にし、患者の予後改善を目指します。
研究手法
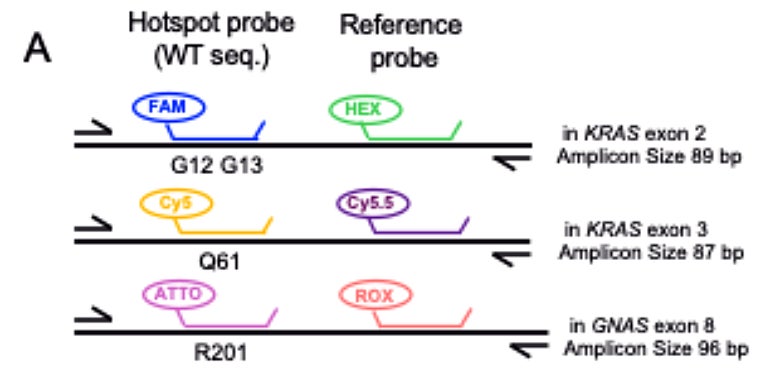
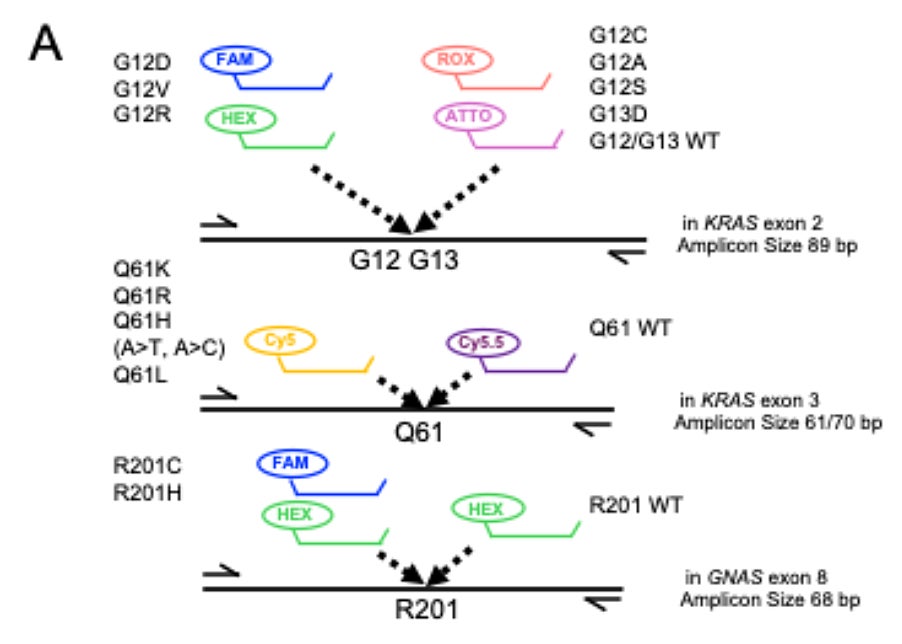
本研究では、膵がんに関連するKRASおよびGNASのホットスポット変異を検出するための2種類の6色マルチプレックスdPCRアッセイ法を構築しました。「PlexScreen-dPCR」(図1)は、Drop-offの原理をベースとしたスクリーニング手法を用い、KRASコドン12/13、61、およびGNASコドン201の変異をその変異種に限らず幅広く検出することを目的としています。一方、「PlexID-dPCR」(図2)は、上記のホットスポットの主要な14種類の変異種を特定するアッセイとして設計されました。どちらの手法も、変異型または野生型を検出する2色の色素プローブを用いたdPCRの反応系を応用し、6色の色素プローブで多くの情報が得られるようにプローブの組み合わせおよび反応条件を検討し、標品DNA・ホルマリン固定パラフィン包埋(FFPE)組織由来DNA・リキッドバイオプシーDNAの各種検体を用い検出感度を評価しました。
研究成果
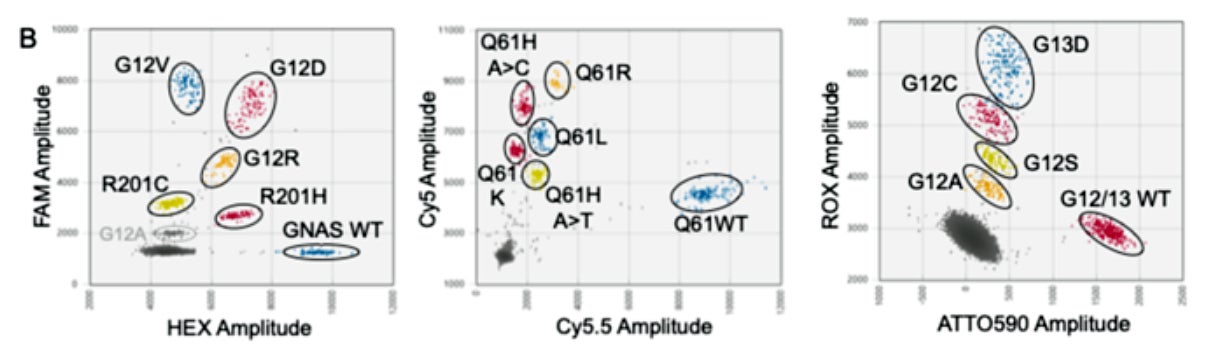
PlexScreen-dPCRにおいて、KRASコドン12/13、61、およびGNASコドン201をカバーするHotspotプローブおよびReferenceプローブを設計してマルチプレックスdPCR条件を最適化した結果、KRAS G12/13の7変異、KRAS Q61の5変異、GNAS R201の2変異が、2次元プロット上で明確な単一蛍光変異クラスターとして検出され(図1)、変異存在頻度の検出限界が最高で0.03–0.06%という高感度の手法であることを示しました(細胞株由来ゲノムDNA)。
一方、PlexID-dPCR法ではKRAS G12D/G12V/G12R/G12A/G12C/G12S/G13D/Q61H(A>T)/ Q61H(A>C)/Q61K/Q61L/Q61R、GNAS R201C/R201Hの14種類の変異プローブと各遺伝子の野生型プローブを6色色素で組み合わせ、単一反応で各変異を同時に測定できるように2次元プロット上のクラスターが明確に分離する条件に最適化しました(図2)。
これらPlexScreen-およびPlexID-dPCRアッセイについて、23検体の膵がん由来FFPE組織(切除腫瘍および細針生検)または12検体の体液を採取し抽出したゲノムDNAを用いて測定した結果、既に得られていた変異情報と高い一致率を示し、両法で定量した変異頻度は、ターゲットシーケンシングと強い相関を示しました(PlexScreen-dPCR: R2=0.985、PlexID-dPCR: R2=0.970)。これらの知見は、両アッセイがKRASおよびGNAS変異(稀な変異を含む)を高い一致率と相関で検出・定量する信頼性の高い診断性能を有することを実証しました。
今後への期待
本研究の成果は、PlexScreen-dPCRとPlexID-dPCRという特徴的な2つのアッセイが膵がんの診断用途において多様性を持つ解析手法となる可能性があることです(表1)。PlexScreen-dPCRは希少変異を含むホットスポット領域のあらゆる変異種の検出を高感度に行うことから健診を含む早期発見につながる対象者の拾い上げや、リキッドバイオプシーによる頻繁な再発モニタリングの場面で有望であることを示しました。一方でPlexID-dPCRは組織サンプルの精密なジェノタイピングを通して薬剤選択やリスク層別化を行うのに力を発揮することが期待されます。
今後、この多色のマルチプレックスdPCR測定系の設計の応用により肺がん・大腸がん・乳がんなどの幅広いがん種のもつそれぞれの「デジタルPCR遺伝子パネル」として展開していくことで大規模シーケンスと比較して時間・コスト効率のアップにより個別化治療の幅を広げることが期待されます。臨床応用に向けた標準化プロトコルの確立を通して、検査展開していくことを目指しています。
用語説明
*1 デジタルPCR(dPCR)
核酸(DNAやRNA)の定量を高感度かつ正確に行うための先進的な分子生物学技術。従来のリアルタイムPCRと異なり、試料を多数の小さな反応区画(ドロップレットやウェル)に分割し、各区画内でPCR増幅を独立して実行します。これにより、核酸分子を個別にカウントでき、高感度な定量が可能となるため、変異アレル頻度の測定や稀な変異の検出に優れており、最低検出限界が0.01%程度まで達する場合もあります。断片化されたサンプル(例:FFPE組織)や低頻度の標的(例:循環腫瘍DNA)での使用にも適しており、がん診断や感染症モニタリングで活用が進んでいます。
【参考図】

研究費
科学研究費助成事業
-
23K06759 (小野裕介) マルチ核酸リキッドバイオプシーによる膵癌の超早期診断
-
24K02431 (水上裕輔) 膵発癌素地の成り立ちと浸潤癌の芽の発生機構に基づく膵癌早期診断
その他の外部資金
-
株式会社 日立ハイテク・旭川医科大学 先進ゲノム地域医療講座
共同研究講座資金(水上裕輔、小野裕介、高橋賢治、孫雁鵬)
-
高松宮妃癌研究基金(水上裕輔)
-
内藤記念科学奨励金・研究助成(水上裕輔)
-
リレー・フォー・ライフ・ジャパン「プロジェクト未来」(水上裕輔)
論文情報
論文名
Six-color multiplex digital PCR assays for comprehensive screening and identification of multiple driver mutations associated with pancreatic carcinogenesis
(膵がん発生に関連する複数のドライバー変異のスクリーニングおよび変異同定のための2つの6色マルチプレックスデジタルPCR)
著者名
前田知歩1、小野裕介1,2,3、高橋賢治2,3,4、森美由紀1、鈴木まゆみ1、玉村伸恵2,4、 孫雁鵬2,4、伊藤泰斗3,4、田中宏樹3、河端秀賢4,岡田哲弘4、小山一也4、大滝有4、 大森優子1,3、山本拓也1,3、水上裕輔1,2,3,4(1札幌東徳洲会病院 医学研究所、2旭川医科大学 先進ゲノム地域医療講座、3国立研究開発法人医薬基盤・健康・栄養研究所 難病・免疫ゲノム研究センター、4旭川医科大学 内科学講座消化器内科学分野)
雑誌名
Clinical Chemistry(臨床化学と診断医学に関する研究を網羅する学術誌)
DOI
10.1093/clinchem/hvaf181
公表日:2026年1月9日(金)(オンライン公開)
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
