NGLY1欠損症の新しい病態モデル
-病態解明や治療法開発に向けた第一歩-
順天堂大学大学院医学研究科 難病の診断と治療研究センター 糖鎖創薬研究室の藤平陽彦 特任助教(理化学研究所客員研究員)、理化学研究所(理研)開拓研究本部鈴木糖鎖代謝生化学研究室 鈴木匡主任研究員らの国際共同研究グループ※は、「NGLY1欠損症」の病態解明や治療法開発に有用な動物モデルの開発に成功しました。
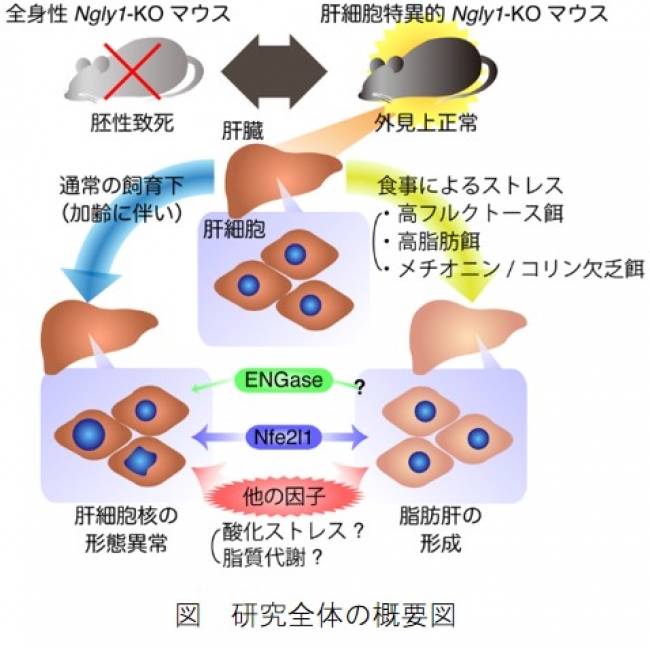 図 研究全体の概要図
図 研究全体の概要図
今回、国際共同研究グループは、マウスの胚性致死性を回避するため、特に新生児の患者に異常が見られる肝臓で特異的にNgly1遺伝子を欠損するマウスを作出しました。驚いたことにマウスは外見上正常に育ちましたが、年を取るに従って肝細胞の核のサイズと形状に異常が見られました。また、高フルクトース餌や高脂肪餌など、食事のストレスを与えると脂肪肝を発症しました。これらの結果から、今回開発したマウスは、これら肝臓における病態発現のメカニズム解析に有用であることが示されました。そして、モデル動物としてNGLY1欠損症の遺伝子治療をはじめとした治療法の検討が可能になりました。
本研究は、欧州の科学雑誌『Biochimica et Biophysica Acta - Molecular Basis of Disease』オンライン版(11月13日)に掲載されました。
1.背景
真核細胞の細胞質に広く存在する「ペプチド:N-グリカナーゼ(PNGase)[1]」は遺伝子名がNgly1であり、タンパク質の品質管理に関わるN-結合型糖鎖脱離酵素[2]です(図1)。鈴木糖鎖代謝生化学研究室ではこれまで、PNGaseの生理機能の研究を進めてきました。
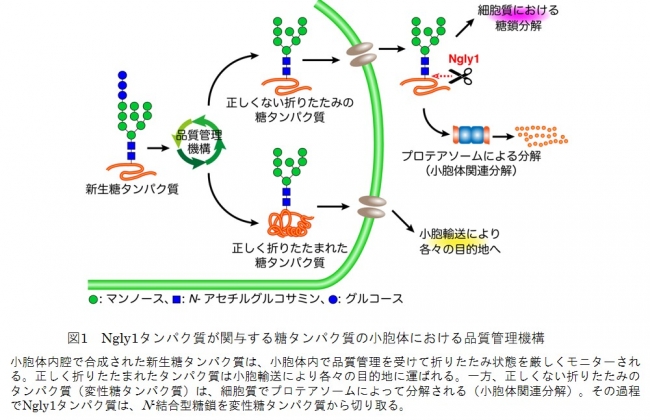 図1 Ngly1タンパク質が関与する糖タンパク質の小胞体における品質管理機構
図1 Ngly1タンパク質が関与する糖タンパク質の小胞体における品質管理機構
これまで、鈴木糖鎖代謝生化学研究室で作出されたNgly1-KOマウスは、実験によく用いられる系統(C57BL/6系統)においては、胚発生過程で異常が生じ、生まれてきませんでした(胚性致死)(注1)。また、同じ系統で別の糖鎖脱離酵素、エンド-β-N-アセチルグルコサミニダーゼ(ENGase)[3]遺伝子(Engase)を同時に欠損させると、一部致死性を回避して生存するマウスが生まれることが分かりました(注1)。しかし、その致死回避率は非常に低いため、一定のマウスをそろえて実験に使うことは難しく、治療のための動物実験は困難な状況でした。
今回、国際共同研究グループは、マウスの胚性致死性を回避し、かつ病態の一部を再現できるようなモデルマウスの確立を目指しました。
(注1)2017年4月22日プレスリリース「NGLY1欠損症の治療標的候補の発見」
http://www.riken.jp/pr/press/2017/20170422_1/
2.研究手法と成果
NGLY1欠損症の患児(特に新生児)に肝機能障害がしばしば見られることから、国際共同研究グループはまず、肝細胞特異的にNgly1遺伝子を欠損したマウス(肝細胞特異的Ngly1-KOマウス)を作出しました。驚いたことに、このマウスは通常の飼育条件で正常に発育し、疾患の表現型を示しませんでした。しかし、加齢に伴って細胞核の肥大化、および核構造の異常が生じることが、肝組織の組織染色および電子顕微鏡観察によって分かりました(図2B)。これまでNgly1-KOマウスの胚性致死は、Engase遺伝子の欠損によって抑制されることが知られていましたが(注1)、この核の形態異常の表現型はEngaseを追加欠損させても、そのような抑制は見られませんでした(図2C)。この結果は、核の形態異常がENGaseの関与する反応とは無関係に引き起こされることを示しています。
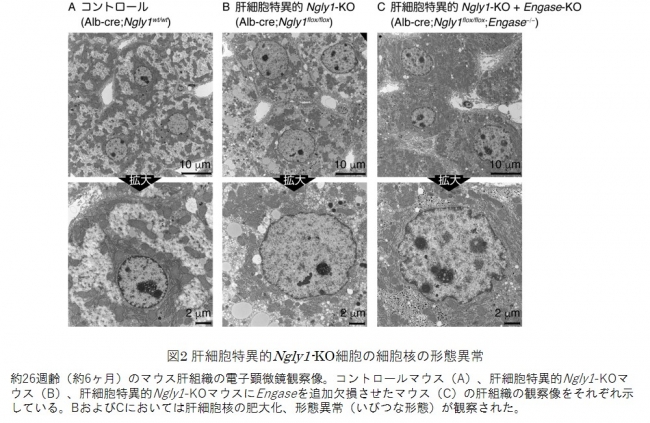 図2 肝細胞特異的Ngly1-KO細胞の細胞核の形態異常
図2 肝細胞特異的Ngly1-KO細胞の細胞核の形態異常
(注2)Lehrbach N. J. and Ruvkun G., Proteasome dysfunction triggers activation of SKN-1A/Nrf1 by the aspartic protease DDI-1, eLife, 5, 2016
(注3)Tomlin F. M., et al., Inhibition of NGLY1 Inactivates the Transcription Factor Nrf1 and Potentiates Proteasome Inhibitor Cytotoxicity, ACS Cent. Sci. 3(11), 2017
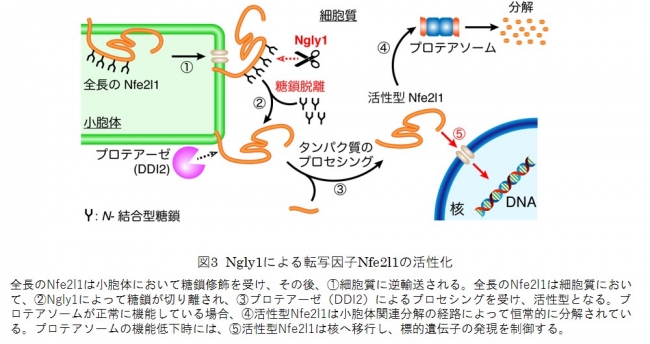 図3 Ngly1による転写因子Nfe2l1の活性化
図3 Ngly1による転写因子Nfe2l1の活性化
また、これらのマウスに高フルクトース餌などの食事ストレスを与えると、肝細胞特異的Ngly1-KOマウスで顕著に脂肪肝の症状を呈することが明らかとなりました(図4)。脂肪肝は高脂肪餌、非アルコール性脂肪肝炎を引き起こすメチオニン/コリン欠乏餌でも引き起こされることから、肝臓においてNgly1が正常な脂質代謝に重要な役割を果たすことが示されました。また、肝臓においてNfe2l1の局在に異常が生じていることが示唆され(図4)、少なくとも肝臓で見出される異常の一部はNfe2l1の機能異常によってもたらされる可能性が示されました。
これらの結果から、Ngly1は肝細胞において核の形態保持と脂質代謝に重要な役割を果たすことが分かり、今回作製した肝細胞特異的Ngly1-KOマウスはNGLY1欠損症における肝機能障害の解析に有用なモデル動物となる可能性が示されました。
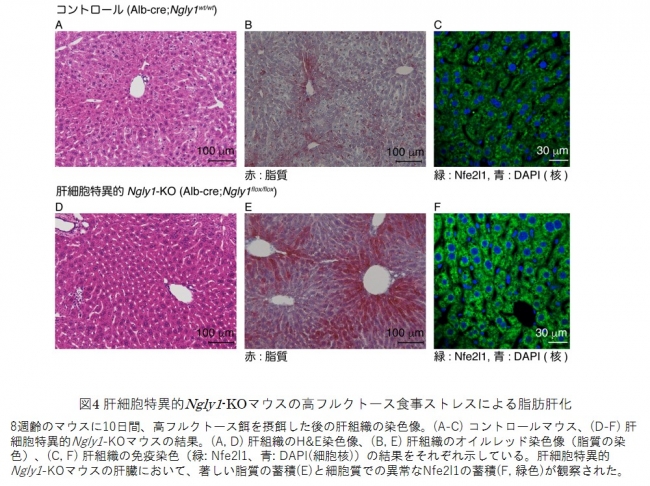 図4 肝細胞特異的Ngly1-KOマウスの高フルクトース食事ストレスによる脂肪肝化
図4 肝細胞特異的Ngly1-KOマウスの高フルクトース食事ストレスによる脂肪肝化
また、これまで鈴木糖鎖代謝生化学研究室は患者団体であるGrace Science Foundationと協調してNgly1研究を推進してきましたが(注4)、本研究はGrace Science Foundationによって研究がサポートされた複数の研究機関が参画した共同研究の成果です。本研究によって開発されたマウスは、NGLY1欠損症の病態解明や治療法開発のためのモデル動物として有用であると期待できます。今後さらに連携を深めることで、NGLY1欠損症の病態解明と治療法の開発に向けた研究を加速していくことを目指しています。
(注4)2016年7月14日トピックス「NGLY1欠損症の解明に向け理研とGrace Science Foundationが連携」
http://www.riken.jp/pr/topics/2016/20160714_2/
4.論文情報
<タイトル>
Liver-specific deletion of Ngly1 causes abnormal nuclear morphology and lipid metabolism under food stress
<著者名>
Haruhiko Fujihira, Yuki Masahara-Negishi, Yoshihiro Akimoto, Hiroto Hirayama, Hyeon-Cheol Lee, Benjamin A. Story, William F. Mueller, Petra Jakob, Sandra Clauder-Münster, Lars M. Steinmetz, Senthil K. Radhakrishnan, Hayato Kawakami, Yoshihiro Kamada, Eiji Miyoshi, Takehiko Yokomizo, and Tadashi Suzuki
<雑誌>
Biochimica et Biophysia Acta – Molecular Basis of Disease
<DOI>
10.1016/j.bbadis.2019.165588
5.補足説明
[1] ペプチド:N-グリカナーゼ(PNGase)
N型の糖鎖を糖タンパク質の根元から切り取る活性のある酵素。遺伝子名はNgly1であり、PNGaseとNgly1は同じタンパク質である。
[2] N-結合型糖鎖脱離酵素
N-結合型糖鎖は、タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖。細胞内では、タンパク質のフォールディング(ポリペプチドの折り畳みによる高次構造の構築)や細胞内での輸送を制御することが分かっている。N-結合型糖鎖脱離酵素は、N-結合型糖鎖をタンパク質の根元から切り離す酵素。
[3] エンド-β-N-アセチルグルコサミニダーゼ(ENGase)
細胞質におけて糖鎖の分解がリソソーム以外の場所でも起こる「糖鎖の非リソソーム分解機構」に関与する脱糖鎖酵素。
[4] 転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の発現を制御する領域(エンハンサー、プロモーター、サイレンサーなど)に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。
[5] プロテアソーム
タンパク質の分解を担う酵素複合体。細胞質や核内の不要になり、ユビキチン化されたタンパク質を分解する(ユビキチンプロテアソーム系)。真核生物に広く保存されており、さまざまな生命現象を制御する。
※共同研究グループ
理化学研究所 開拓研究本部 鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡 (すずき ただし)
客員研究員 藤平 陽彦 (ふじひら はるひこ)(順天堂大学大学院医学研究科 難病の診断と治療研究センター
糖鎖創薬研究室 特任助教)
研究員 平山 弘人 (ひらやま ひろと)
環境資源科学研究センター バイオ高分子研究チーム
テクニカルスタッフ 正原(根岸) 由紀(まさはら(ねぎし) ゆき)
順天堂大学大学院 医学研究科 生化学・細胞機能制御学
教授 横溝 岳彦 (よこみぞ たけひこ)
助教 李 賢喆 (Hyeon-Cheol Lee)
大阪大学大学院 医学系研究科 保健学専攻 機能診断科学講座
教授 三善 英知 (みよし えいじ)
准教授 鎌田 佳宏 (かまだ よしひろ)
杏林大学 医学部 顕微解剖学教室
教授 秋元 義弘 (あきもと よしひろ)
客員教授 川上 速人 (かわかみ はやと)
EMBL Heidelberg Genome Biology Unit
Senior Scientist ラース・スタインメッツ(Lars M. Steinmetz)
Staff Scientist ウィリアム・ミュラー(William F. Mueller)
Research Technician ペトラ・ヤーコブ(Petra Jakob)
Lab Manager サンドラ・クラウダー-ミュンスター(Sandra Clauder-Münster)
Virginia Commonwealth University Department of Pathology University
Assistant Professor センチル・ラーダークリシュナン(Senthil K. Radhakrishnan)
※研究支援
本研究は、東レ科学振興会、グレース科学財団、三木谷浩史氏(以上、研究代表者:鈴木匡)、日本学術振興会(JSPS)科学研究費補助金若手研究(B)「Ngly1/ENGase欠損がマウスに招く致死性/致死性回避のメカニズム解明、同若手研究「細胞質における糖鎖分解の造血発生制御における役割の解明」(研究代表者:藤平陽彦)」による支援を受けて行われました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
