老人性難聴の進行に関わるメカニズムを解明
~内耳で働く “ギャップ結合”が老化により劣化していく~
順天堂大学大学院医学研究科耳鼻咽喉科学(主任教授・池田勝久)の神谷和作准教授、田島勝利大学院生らの研究チームは、老人性難聴(*1)の初期に起こる新たなメカニズムを明らかにしました。研究チームが内耳の「ギャップ結合(*2)」という分子の複合体に注目して解析したところ、この分子が老化に伴って崩壊・減少し、老人性難聴の進行に関与する可能性が示されました。このメカニズムの解明により、当研究チームが現在開発中の内耳ギャップ結合を標的とした薬剤や遺伝子治療が老人性難聴にも適用できる可能性があります。本研究はネイチャー系列誌「Experimental & Molecular Medicine」に掲載されました。
【本研究成果のポイント】
【背景】
老人性難聴(加齢性難聴)は老化に伴う進行的な聴力障害で、場合によっては40代で補聴器がを必要になる例も少なくありません。最近では、認知症の発症リスクを高める最も大きな要因に中年期以降の聴力低下(老人性難聴)が含まれるとのデータが報告され、老人性難聴への早期予防が認知症予防の最重要項目の一つであると考えられています。
今回着目した内耳ギャップ結合は内耳のイオン環境を整える重要な分子構造であり、遺伝性難聴では、検出される遺伝性難聴の半数程度はギャップ結合遺伝子(GJB2遺伝子など)の異常によるコネキシン26遺伝子変異型難聴(*3)であることがわかってきました。
研究チームでは2014年に内耳ギャップ結合構造の崩壊による遺伝性難聴の発症メカニズムを解明(*a)、2015年にモデル動物の遺伝子治療実験によりギャップ結合の修復と聴力回復に成功(*b)、2016年にはiPS細胞から内耳ギャップ結合を作る基盤技術を開発(*c)し、内耳ギャップ結合を標的とした創薬や遺伝子治療の技術開発を進めています。その中で老人性難聴にもこれらの新しい治療法が役立つ可能性があると考え、メカニズムの解析を進めました。
*a プレスリリース: 遺伝性難聴の原因メカニズムを解明 https://www.juntendo.ac.jp/graduate/pdf/news07.pdf
*b プレスリリース: 遺伝性難聴の根本的治療に成功 https://www.juntendo.ac.jp/graduate/pdf/news18.pdf
*c プレスリリース: iPS細胞から遺伝性難聴の原因となる内耳ギャップ結合形成細胞を作製 https://www.juntendo.ac.jp/graduate/pdf/news34.pdf
【内容】
研究チームは、老人性難聴の初期の変化が病態進行のメカニズムや治療法を探る鍵となると考えました。そこでまず、モデル動物(マウス)を用い聴力が急激に低下する時期を特定し、その際に内耳に起こる遺伝子やタンパク質の変化を観察しました。従来の報告では、老人性難聴は内耳の有毛細胞と呼ばれる感覚細胞の脱落が主な原因という説がありましたが、病態初期には有毛細胞はまだ正常に存在していました。しかし、内耳の重要な分子構造であるギャップ結合の複合体とその構成成分であるコネキシン26とコネキシン30を解析したところ、若年期に比べてギャップ結合複合体の構造が著しく崩壊しており、構成成分であるコネキシン26とコネキシン30タンパク質の量も大きく減少していました。そこで、ギャップ結合複合体の構造を詳細に解析したところ、老化初期の内耳(32週齢)ではこの構造は分断され、2マイクロメートル程度と若年期(5マイクロメートル程度)に比べて大きく減少していました。さらにタンパク質量を測定すると老化初期の内耳では若年期の約40%に減少していました。次に、ギャップ結合タンパク質の生化学的な特性を調べたところ、老化の影響でギャップ結合は脂質に取り囲まれたり共存するようになるという性質の変化があることが分かりました。
以上の結果から、この現象が安定したギャップ結合複合体を維持することを妨げて分解されやすくなり、タンパク質量が低下することでギャップ結合の劣化・老化につながっていることが考えられました。さらに、ギャップ結合機能の低下は、内耳が活動するためのリンパ液の電位の低下や、内耳の感覚細胞である有毛細胞の活動低下を伴うため、老化による聴力の低下に大きな影響を与えることが考えられます(図 )。
研究チームは内耳のギャップ結合を修復するための医薬品や遺伝子治療ベクターの開発を進めています。現在、老人性難聴の根本的治療法や治療薬はありませんが、将来的には、研究チームが開発中のギャップ結合タンパク質を安定化する薬剤やコネキシンを補充する遺伝子治療の開発によって老人性難聴の予防や聴力の回復が期待できます。
【用語説明】
*1 老人性難聴: 老人性難聴(加齢性難聴)は老化に伴う進行的な聴力障害で、場合によっては40代で補聴器が必要になる例も少なくない。最近では、認知症の発症リスクを高める最も大きな要因は中年期以降の聴力低下(老人性難聴)であるとのデータが医学誌Lancetで報告され、認知症予防の観点からも老人性難聴への早期予防が最重要項目の一つであると考えられている。
*2 ギャップ結合: コネキシンは6個の集合体により細胞膜に分子の通り道を作り、隣の細胞の集合体と連結して細胞と細胞をつなぐトンネルを作る。このギャップ結合は分子量約1000以下の低分子やイオンを濃度勾配によって透過させ、細胞間の物質輸送を可能とする。
*3 コネキシン26・GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴): コネキシン26は遺伝子GJB2(GAP JUNCTION PROTEIN, BETA-2)により合成され、内耳のギャップ結合を構成する主要タンパク質の一つ。最も高頻度に検出される遺伝性難聴の原因因子。 GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴)は、我が国では遺伝性難聴の50%以上もの割合を占めるとされており、常染色体劣性と常染色体優性の遺伝形式を持つ感音性難聴。
【原著論文】
タイトル: 「Degradation and modification of cochlear gap junction proteins in the early development of age-related hearing loss」
タイトル(日本語訳):加齢性難聴の初期に起こる蝸牛ギャップ結合の分解と変形 著者: Shori Tajima, Keiko Danzaki, Katsuhisa Ikeda, Kazusaku Kamiya
著者(日本語表記):田島勝利、檀崎(金山)敬子、池田勝久、神谷和作
所属:順天堂大学大学院医学研究科耳鼻咽喉科学 掲載誌: Experimental & Molecular Medicine (2020) 52:166–175
DOI: 10.1038/s12276-020-0377-1
本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業(研究開発代表者 神谷和作)、AMED次世代治療・診断実現のための創薬基盤技術開発事業(研究開発代表者 神谷和作)、文部科学省科学研究費 基盤研究B (研究代表者 神谷和作)、武田科学振興財団などの支援を受け行われました。
- 老人性難聴の初期に起こる新たなメカニズムを明らかにした
- 老化に伴って内耳の「ギャップ結合」という構造体が疎水化・断片化し、タンパク質量が低下していた
- ギャップ結合の異常は遺伝性難聴の原因と共通しており、同じ治療法が適用できる可能性
【背景】
老人性難聴(加齢性難聴)は老化に伴う進行的な聴力障害で、場合によっては40代で補聴器がを必要になる例も少なくありません。最近では、認知症の発症リスクを高める最も大きな要因に中年期以降の聴力低下(老人性難聴)が含まれるとのデータが報告され、老人性難聴への早期予防が認知症予防の最重要項目の一つであると考えられています。
今回着目した内耳ギャップ結合は内耳のイオン環境を整える重要な分子構造であり、遺伝性難聴では、検出される遺伝性難聴の半数程度はギャップ結合遺伝子(GJB2遺伝子など)の異常によるコネキシン26遺伝子変異型難聴(*3)であることがわかってきました。
研究チームでは2014年に内耳ギャップ結合構造の崩壊による遺伝性難聴の発症メカニズムを解明(*a)、2015年にモデル動物の遺伝子治療実験によりギャップ結合の修復と聴力回復に成功(*b)、2016年にはiPS細胞から内耳ギャップ結合を作る基盤技術を開発(*c)し、内耳ギャップ結合を標的とした創薬や遺伝子治療の技術開発を進めています。その中で老人性難聴にもこれらの新しい治療法が役立つ可能性があると考え、メカニズムの解析を進めました。
*a プレスリリース: 遺伝性難聴の原因メカニズムを解明 https://www.juntendo.ac.jp/graduate/pdf/news07.pdf
*b プレスリリース: 遺伝性難聴の根本的治療に成功 https://www.juntendo.ac.jp/graduate/pdf/news18.pdf
*c プレスリリース: iPS細胞から遺伝性難聴の原因となる内耳ギャップ結合形成細胞を作製 https://www.juntendo.ac.jp/graduate/pdf/news34.pdf
【内容】
研究チームは、老人性難聴の初期の変化が病態進行のメカニズムや治療法を探る鍵となると考えました。そこでまず、モデル動物(マウス)を用い聴力が急激に低下する時期を特定し、その際に内耳に起こる遺伝子やタンパク質の変化を観察しました。従来の報告では、老人性難聴は内耳の有毛細胞と呼ばれる感覚細胞の脱落が主な原因という説がありましたが、病態初期には有毛細胞はまだ正常に存在していました。しかし、内耳の重要な分子構造であるギャップ結合の複合体とその構成成分であるコネキシン26とコネキシン30を解析したところ、若年期に比べてギャップ結合複合体の構造が著しく崩壊しており、構成成分であるコネキシン26とコネキシン30タンパク質の量も大きく減少していました。そこで、ギャップ結合複合体の構造を詳細に解析したところ、老化初期の内耳(32週齢)ではこの構造は分断され、2マイクロメートル程度と若年期(5マイクロメートル程度)に比べて大きく減少していました。さらにタンパク質量を測定すると老化初期の内耳では若年期の約40%に減少していました。次に、ギャップ結合タンパク質の生化学的な特性を調べたところ、老化の影響でギャップ結合は脂質に取り囲まれたり共存するようになるという性質の変化があることが分かりました。
以上の結果から、この現象が安定したギャップ結合複合体を維持することを妨げて分解されやすくなり、タンパク質量が低下することでギャップ結合の劣化・老化につながっていることが考えられました。さらに、ギャップ結合機能の低下は、内耳が活動するためのリンパ液の電位の低下や、内耳の感覚細胞である有毛細胞の活動低下を伴うため、老化による聴力の低下に大きな影響を与えることが考えられます(図 )。
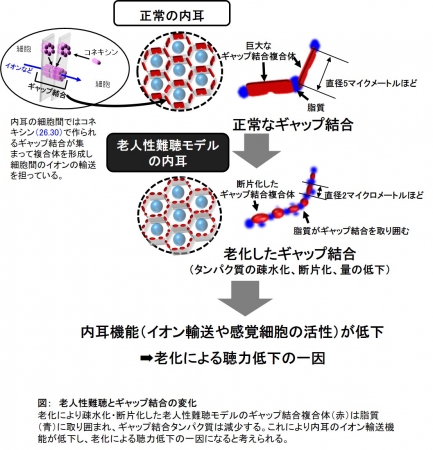 図: 老人性難聴とギャップ結合の変化
図: 老人性難聴とギャップ結合の変化
研究チームは内耳のギャップ結合を修復するための医薬品や遺伝子治療ベクターの開発を進めています。現在、老人性難聴の根本的治療法や治療薬はありませんが、将来的には、研究チームが開発中のギャップ結合タンパク質を安定化する薬剤やコネキシンを補充する遺伝子治療の開発によって老人性難聴の予防や聴力の回復が期待できます。
【用語説明】
*1 老人性難聴: 老人性難聴(加齢性難聴)は老化に伴う進行的な聴力障害で、場合によっては40代で補聴器が必要になる例も少なくない。最近では、認知症の発症リスクを高める最も大きな要因は中年期以降の聴力低下(老人性難聴)であるとのデータが医学誌Lancetで報告され、認知症予防の観点からも老人性難聴への早期予防が最重要項目の一つであると考えられている。
*2 ギャップ結合: コネキシンは6個の集合体により細胞膜に分子の通り道を作り、隣の細胞の集合体と連結して細胞と細胞をつなぐトンネルを作る。このギャップ結合は分子量約1000以下の低分子やイオンを濃度勾配によって透過させ、細胞間の物質輸送を可能とする。
*3 コネキシン26・GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴): コネキシン26は遺伝子GJB2(GAP JUNCTION PROTEIN, BETA-2)により合成され、内耳のギャップ結合を構成する主要タンパク質の一つ。最も高頻度に検出される遺伝性難聴の原因因子。 GJB2変異遺伝性難聴(コネキシン26遺伝子変異型難聴)は、我が国では遺伝性難聴の50%以上もの割合を占めるとされており、常染色体劣性と常染色体優性の遺伝形式を持つ感音性難聴。
【原著論文】
タイトル: 「Degradation and modification of cochlear gap junction proteins in the early development of age-related hearing loss」
タイトル(日本語訳):加齢性難聴の初期に起こる蝸牛ギャップ結合の分解と変形 著者: Shori Tajima, Keiko Danzaki, Katsuhisa Ikeda, Kazusaku Kamiya
著者(日本語表記):田島勝利、檀崎(金山)敬子、池田勝久、神谷和作
所属:順天堂大学大学院医学研究科耳鼻咽喉科学 掲載誌: Experimental & Molecular Medicine (2020) 52:166–175
DOI: 10.1038/s12276-020-0377-1
本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業(研究開発代表者 神谷和作)、AMED次世代治療・診断実現のための創薬基盤技術開発事業(研究開発代表者 神谷和作)、文部科学省科学研究費 基盤研究B (研究代表者 神谷和作)、武田科学振興財団などの支援を受け行われました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
