医療機器に関する各国の規制・制度の調査レポートを公表
~プログラム医療機器などの開発・展開にかかる実態を体系的に調査~
株式会社日本総合研究所(本社: 東京都品川区、代表取締役社長: 内川淳、以下「日本総研」)は、「医療機器のグローバル展開・プログラム医療機器開発に向けての視座」(以下「本レポート」)としてまとめましたので公表します。本レポートでは、プログラム医療機器(Software as a Medical Device、以下「SaMD」)を中心に、医療機器の開発およびグローバル展開を円滑に行うために必要な各国の規制や制度、ビジネスの実態などの知識・情報・視座について、体系的な調査と整理が行われています。
なお、本レポートは、日本総研が国立研究開発法人日本医療研究開発機構(以下「AMED」)から「医療機器等研究成果展開事業(※1) 医療機器事業化・実用化支援機関 医療機器開発における事業化・実用化支援」の委託を受け、作成したものです。
本レポートは、以下からご覧になれます。
『より円滑な医療機器のグローバル展開やプログラム医療機器の開発に向けた「医療機器のグローバル展開・プログラム医療機器開発に向けての視座」レポート』(日本総研ホームページ/2025年9月24日)
https://www.jri.co.jp/column/opinion/detail/16116/
■本レポート作成の背景と目的
2024年3月に経済産業省が発表した「医療機器産業ビジョン2024」(※2)では、医療機器のグローバル展開による資金の獲得と再投資による成長循環が基本方針として示され、特に、近年新技術の開発が進むプログラム医療機器に注力することが方針として打ち出されました。
医療機器のグローバル展開にあたっては、地域・国ごとの事業機会領域を適切に見いだした上で、参入に向けた研究開発テーマを設定します。また、研究開発や事業戦略を検討する際は、対象地域・国の薬事規制・保険償還制度・医療提供体制などの特徴や留意点を予め把握しておくことが必要となります。
SaMDの開発では、本邦で進められている、産業化を促進するための規制改革や診療報酬制度改革について理解を深めておかなければなりません。産業化の萌芽段階にあるSaMDには実用化および普及促進における課題が山積しており、それらを解決するための新たな研究シーズの創造や課題を前提とした開発・事業戦略の構築も重要です。
また、SaMDのグローバル展開においては、特に本邦とは異なる個人情報保護規制が存在することに留意が必要です。そのため研究開発の早期段階から、規制を遵守した個人情報の活用や保護するためのシステム構築等に取り組まなければなりません。さらに、本邦とは異なる保険制度を前提とした事業モデルの創造することも、新たに参入していくのに不可欠です。
こうした中で日本企業が医療機器の開発やグルーバル展開をより円滑に行う際の参考となるよう、医療機器のグローバル展開・プログラム医療機器開発に向けての視座について、下記に示す3部構成のレポートとして取りまとめました。
●欧州の規制・許認可に基づいた医療機器開発の視座
●国内のSaMD製品の保険収載・ビジネスの実態と開発・薬事戦略の視座
●海外のSaMD製品の保険収載・ビジネスの実態と開発・薬事戦略の視座
■本レポートの主な特徴
①欧州におけるベンチャー投資、オープンイノベーション注力領域に着目した機会領域の洞察
本レポートでは、欧州を拠点とする医療機器ベンチャー企業の資金調達動向を調査し、資金調達が特に盛んな疾患領域・製品領域を分析しています。その上で、資金調達が盛んな要因を分析すると共に、欧州市場から求められるプロダクト開発への示唆を提示しました。
また、技術革新の加速に伴い、欧州の大手医療機器メーカーは、オープンイノベーション活動を積極的に推進し、共同研究・開発、販路拡大提携、M&Aなど、多様な戦略を展開しています。本レポートでは、それらのうち売上高上位10社に着目し、ベンチャー企業およびアカデミアとのオープンイノベーション活動の実態を分析しました。
②欧州の薬事規制の基礎である欧州医療機器規則の全体像、本邦との相違点を丁寧に解説
本レポートでは、欧州の薬事規制の基礎である欧州医療機器規則(Medical Device Regulation: MDR)について、従来の医療機器指令(Medical Devices Directive: MDD)からの主な変更点を示すと共に、全体像を理解するため、MDRの条文構成とその概要や付属書の構成について解説しています。また、医療機器開発の早期段階から検討が必要な「医療機器分類」「安全性や性能要件」「臨床評価と市販後監視」「企業の義務と役割」などについて、参照すべき条項や付属書を示しながら、詳細に解説しています。
さらに、欧州に製品展開をしている有識者や欧州の規制専門家へのヒアリングを実施し、「本邦規制との相違点」「MDRに特徴的な留意すべき規格」「日本で収集したデータの戦略的活用」といったノウハウをコラム記事として掲載しています。
③本邦における治療用プログラムの臨床的位置づけ・開発期間・臨床試験について詳細に解説
治療用プログラムの開発では、開発早期段階から臨床的位置づけの詳細化、特に診療報酬で評価されるための臨床的意義の明確化が重要です。また、臨床的位置づけを検証するための臨床試験計画を前提に、早期段階から開発に取り組むべき事項も明確化しなければなりません。
しかし、これらの情報は体系的に整理されておらず、研究者の情報収集活動に支障を来すことも少なくありません。そこで本レポートでは、本邦で製造販売承認を取得したSaMD製品を対象に、臨床的位置づけ、開発に要した期間、臨床試験計画の設計について、SaMD開発に関する様々なガイダンスでの留意事項を参照しながら、詳細に解説しています。
④本邦におけるSaMD保険償還の実態、診療報酬で評価されるために不可欠な検討事項を解説
本邦では、令和6年度の診療報酬改定において、SaMDの保険償還の考え方が示されました。本レポートでは、令和6年度保険医療材料制度改革の骨子で示された「プログラム医療機器の有用性の評価に関する基準」を解説すると共に、疾病診断用および治療用プログラムでの保険償還事例を詳細に解説しています。SaMDでは製造販売承認を得たものの診療報酬にて評価されない製品が多数存在しており、そうした事例を基に診療報酬で評価されるためのデータ取得の方法、具体的に保険適用を希望する際の選択肢や保険適用を目指す場合の留意点を詳述しています。
⑤欧米の個人情報保護規制の概要とSaMD開発における留意点を弁護士が解説
開発したSaMDを欧米に展開する際は、各国の個人情報保護規制の遵守が不可欠です。本レポートでは、第一に日本と欧州・米国における個人情報保護規制の主要な相違点について解説しています。その上で、欧州について、EU加盟国共通の規則である「EU一般データ保護規則(EU General Data Protection Regulation: GDPR)」の概要を解説した上で、EU各国のヘルスデータに関する法規およびその取り扱いについて解説しています。また、米国については、欧州と異なり、個人情報保護の分野において、公的部門および民間部門を包括的に規制する連邦レベルでの制定法は存在しないものの、事実上、プライバシー・個人情報保護のための規制として執行されている「不公正若しくは欺瞞的な行為又は慣行」を禁止する「連邦取引委員会法(Federal Trade Commission Act, FTC法)5条」および「健康保険の携行性及び説明責任に関する法律(Health Insurance Portability and Accountability Act of 1996, HIPAA)」について解説を行っています。
さらに、SaMDのシステム構成を示しながら、システムの各階層において法的側面から実装にあたり留意すべき点を解説しています。
⑥全容理解が難しい米国の民間保険制度と民間保険を活用したSaMDの利活用実態を解説
本レポートでは、本邦とは仕組みの異なる米国の民間保険制度について、加入条件や給付の条件などのサービス内容を定める「保険プラン」、保険サービスが利用可能な病院などを定める「ネットワーク」、保険の給付対象を定める「フォーミュラリ」といったなじみのない制度の要点について解説しています。その上で、保険者が給付対象とするSaMD製品を定める「Digital Health Formulary」とこのフォーミュラリに掲載されるまでの審査工程や要件について解説すると共に、ある保険者が給付対象とするSaMDの製品領域や具体的な製品事例について解説しています。
さらに、民間保険者に訴求するためのSaMD製品開発の取り組み事例、保険に頼らない新たなサービス提供の先進的な取り組み事例を解説しています。
■本レポートの作成体制
本レポートは、下記の方々の原稿執筆、寄稿、情報提供によって作成された。
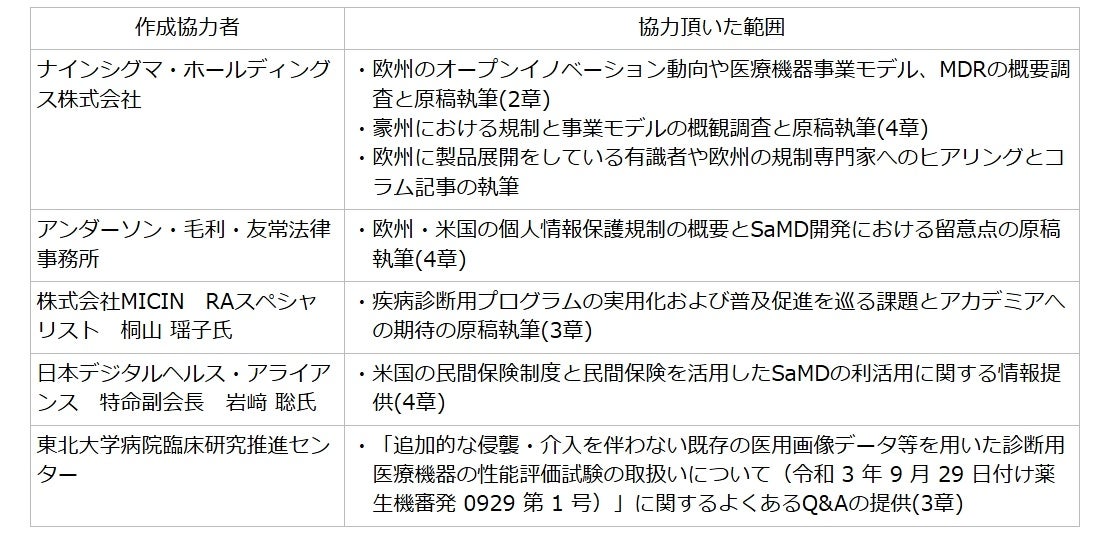
(※1)医療機器等研究成果展開事業
医療機器基本計画等に基づき、AIやデータを活用した診断、低侵襲の診断・治療機器といった重点領域を意識した革新的・独創的な技術シーズの基礎・応用研究開発を支援する、AMEDの事業です。開発した医療機器・システムは製造販売企業へ導出して実用化を図るとともに、世界の医療の革新のために、米国・欧州等の先進国を含む海外市場への展開を見据えています。
本事業では、2023年度に「早期段階の医療機器開発を成功に導き、実用化を促進するために必要な視座」として、本事業で得られた知見をもとにレポート及び実用化に向け陥りやすい失敗事例集を作成し、AMEDホームページにて公表しています。
●早期段階の医療機器開発を成功に導き、実用化を促進するために必要な視座
https://www.amed.go.jp/content/000126831.pdf
●実用化に向け陥りやすい失敗事例集
https://www.amed.go.jp/content/000126478.pdf
(※2)医療機器産業ビジョン2024
https://www.meti.go.jp/policy/mono_info_service/healthcare/iryou/downloadfiles/pdf/iryoukikisangyouvision2024/iryoukikisangyouvision2024.html
■本件に関するお問い合わせ先
【報道関係者様】広報部 山口 電話:080-7154-5017
【一般のお客様】リサーチ・コンサルティング部門 南雲 (nagumo.shunichiro@jri.co.jp)
すべての画像
