脳神経細胞内オートファジーを可視化する動物モデルを開発
~老化・神経変性疾患におけるオートファジー機能の解明にむけて~
順天堂大学大学院医学研究科神経疾患病態構造学講座の内山安男 特任教授、谷田以誠 先任准教授らの研究グループは、脳神経細胞内のオートファジー(*1)を可視化するモデルマウスを開発しました。本研究によりモデルマウスにオートファジーを人為的に誘導すると、脳神経細胞内のオートファジーを蛍光シグナルとして検出することができるようになりました。本研究成果により脳神経細胞のオートファジーの機能評価を個体レベルで長期間モニターすることが可能となり、神経細胞の異常タンパク質の溜まり病や老化に関わるオートファジーの機能解明および治療薬開発への応用が期待されます。本論文はScientific Reports誌のオンライン版に2020年6月15日付で公開されました。
本研究成果のポイント
背景
脳神経細胞において細胞の老廃物を分解するオートファジー機能の低下はパーキンソン病、アルツハイマー病、バッテン病(*2)などの神経変性疾患と深い関わりがあります。また、オートファジーは老化により機能が低下します。マウスの脳にオートファジー不全を人為的に引き起こすと、神経変性疾患に似た症状を示し、寿命も短くなります。脳神経におけるオートファジー機能、とりわけ老化・神経変性疾患におけるオートファジー機能を評価するためには脳神経細胞のオートファジーを個体レベルで長期間、モニターできるモデルマウスが必要でした。これまでに様々な臓器において長期間オートファジーを可視化するモデルマウスが開発されてきた一方で、脳神経細胞内のオートファジーを長期間モニターできるモデルマウスについては存在しないことが課題となっていました。そこで研究グループは2014年に開発した、オートファジーをモニターする蛍光プローブ(*3)を応用して、脳神経細胞のオートファジーを可視化できるモデルマウスの作成を試みました。
内容
オートファジーが誘導されると、細胞質を取り囲むようにオートファゴソーム(*4)が形成されます(図1)。 オートファゴソームはリソソームと融合し、オートリソソーム(*5)となり、内包物を分解します。研究グループが開発したPK-LC3(pHluorin-mKate2-human LC3B)蛍光プローブは、オートファゴソーム・オートリソソームのマーカーであるLC3に、pH感受性の緑色蛍光タンパク質変異体pHluorinと赤色蛍光タンパク質mKate2を融合させたタンパク質です。光の三原色により、「緑」+「赤」は「黄色」になることから、オートファジーが誘導されると、PK-LC3はオートファゴソームに局在して黄色蛍光のドットとして検出できるようになります。リソソームと融合してオートリソソームが融合すると、オートリソソーム内が酸性になり赤色蛍光ドットのみが検出されるようになります。
このPK-LC3 tg マウスにオートファジーを誘導すると、肝臓、腎臓、膵臓において、PK-LC3由来の蛍光ドットが増加しました。脳組織内では、大脳皮質、海馬CA1領域(*6)、歯状回(*7)、小脳プルキンエ層(*8)、小脳核、脊髄、いずれの神経細胞においても、オートファジーを誘導することでPK-LC3由来の蛍光ドットが増加していました(図2)。
今後の展開
老化や神経変性疾患の多くは、数十年の時を経て起こります。そのため、老化や神経変性疾患におけるオートファジーを評価・解明するためには、個体レベルで長期間(数ヶ月から数年)オートファジー機能を評価できるモデルマウスが必要です。しかし、これまではモデルマウスが存在しないことから、培養神経細胞を用いたり脳内にウイルスベクター(*9)を感染させてオートファジーを検出する手法に限定されていました。本研究で開発したPK-LC3tgマウスは、神経変性疾患として知られる“分解されない物質が神経細胞内に溜まる難病(パーキンソン病、アルツハイマー病、プリオン病、バッテン病、筋萎縮性側索硬化症など)”や老化に伴う脳神経内オートファジーの機能低下の研究を加速するための強力なツールとなることが期待されます。今後、老化・神経変性疾患による経時的な脳神経内オートファジーの変化を解析するとともに、将来的には脳神経内オートファジーの抑制を指標とした、老化や神経変性疾患に対する治療薬開発につながることが期待されます。
用語解説
*1 オートファジー:細胞内バルク分解システムで神経変性疾患や腫瘍化など多くの疾患に関与。オートファジーの研究で大隅良典博士がノーベル賞受賞。
*2 バッテン病(神経セロイドリポフスチン症):常染色体劣性遺伝性リソソーム病のひとつ。乳幼児期から小児期にかけて神経系の障害として発症する進行性の遺伝性神経変性疾患。
*3 蛍光プローブ:蛍光タンパク質の蛍光を利用して、生命現象を可視化するツール。
*4 オートファゴソーム:オートファジーが誘導されると形成される、分解するべき細胞質を取り囲む膜構造体。オートファゴソームが形成された時点では内包物の分解はまだ起こっていない。
*5 オートリソソーム:オートファゴソームにリソソームが融合し、分解酵素による内包物の分解が起こる。
*6 海馬CA1領域:海馬は大脳辺縁系の一部である海馬体の一部で脳の記憶や空間学習能力に関与。海馬の錐体細胞層はCA1、CA2、CA3に分類される。CAはフランスの解剖学者Garengeotが1742年に「エジプトの太陽神アモン神の角(アンモン角)(Cornu Ammonis)」と命名したことが由来。
*7 歯状回:海馬とともに海馬体の一部。海馬歯状回とも呼ばれる。記憶や学習といった脳高次機能に関与。
*8 小脳プルキンエ層:小脳皮質内のプルキンエ細胞が形成している層。運動制御及び運動学習・運動記憶に関与
*9 ウイルスベクター:遺伝子操作により、複製や増殖能を欠失させたウイルスをもちいて遺伝物質を細胞内に輸送するためのツール。
原著論文
本研究はScientific Reports誌に(2020年6月15日付)公開されました。
タイトル: Characterization of starvation-induced autophagy in cerebellar Purkinje cells of pHluorin-mKate2-human LC3B transgenic mice.
タイトル(日本語訳): pHluorin-mKate2-human LC3B トランスジェニックマウスのプルキンエ細胞におけるオートファジーの解析
著者:Juan Alejandro Oliva Trejo, Isei Tanida, Chigure Suzuki, Soichiro Kakuta, Norihiro Tada, and Yasuo Uchiyama
著者(日本語表記):オリバ トレホ・アレハンドロ1、谷田以誠1、鈴木ちぐれ1、角田宗一郎1、多田昇弘2、内山安男1
著者所属:1 順天堂大学大学院医学研究科神経疾患病態構造学講座、2 順天堂大学大学院医学研究科アトピー疾患研究センター
DOI: 10.1038/s41598-020-66370-6
本研究は国立研究開発法人日本医療研究開発機構(AMED)「老化メカニズム解明・制御プロジェクト」研究費 (18gm5010003)、文部科学省私立大学戦略的研究基盤形成事業、日本学術振興会(JSPS)科研費(JP15K12749)、順天堂大学老人性疾患病態・治療研究センター研究奨励費の支援を受けて、実施されました。
- 脳神経細胞内オートファジーを可視化するPK-LC3 tg モデルマウスを作成
- 脳神経内オートファジー機能を蛍光ドットとして評価して長期間モニターできる
- 老化・神経変性疾患に関わる脳神経内オートファジーの機能解明・治療薬開発へ
背景
脳神経細胞において細胞の老廃物を分解するオートファジー機能の低下はパーキンソン病、アルツハイマー病、バッテン病(*2)などの神経変性疾患と深い関わりがあります。また、オートファジーは老化により機能が低下します。マウスの脳にオートファジー不全を人為的に引き起こすと、神経変性疾患に似た症状を示し、寿命も短くなります。脳神経におけるオートファジー機能、とりわけ老化・神経変性疾患におけるオートファジー機能を評価するためには脳神経細胞のオートファジーを個体レベルで長期間、モニターできるモデルマウスが必要でした。これまでに様々な臓器において長期間オートファジーを可視化するモデルマウスが開発されてきた一方で、脳神経細胞内のオートファジーを長期間モニターできるモデルマウスについては存在しないことが課題となっていました。そこで研究グループは2014年に開発した、オートファジーをモニターする蛍光プローブ(*3)を応用して、脳神経細胞のオートファジーを可視化できるモデルマウスの作成を試みました。
内容
オートファジーが誘導されると、細胞質を取り囲むようにオートファゴソーム(*4)が形成されます(図1)。 オートファゴソームはリソソームと融合し、オートリソソーム(*5)となり、内包物を分解します。研究グループが開発したPK-LC3(pHluorin-mKate2-human LC3B)蛍光プローブは、オートファゴソーム・オートリソソームのマーカーであるLC3に、pH感受性の緑色蛍光タンパク質変異体pHluorinと赤色蛍光タンパク質mKate2を融合させたタンパク質です。光の三原色により、「緑」+「赤」は「黄色」になることから、オートファジーが誘導されると、PK-LC3はオートファゴソームに局在して黄色蛍光のドットとして検出できるようになります。リソソームと融合してオートリソソームが融合すると、オートリソソーム内が酸性になり赤色蛍光ドットのみが検出されるようになります。
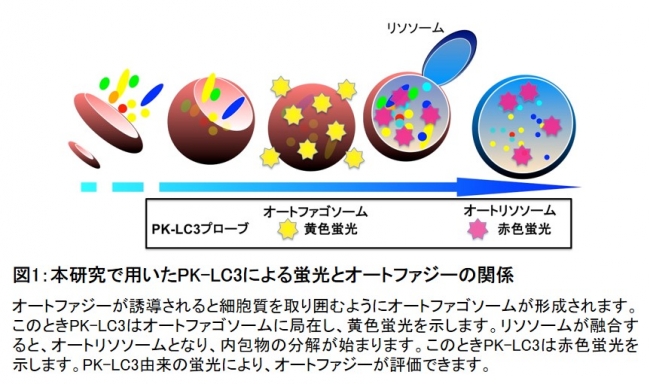 図1:本研究で用いたPK-LC3による蛍光とオートファジーの関係
図1:本研究で用いたPK-LC3による蛍光とオートファジーの関係
このPK-LC3 tg マウスにオートファジーを誘導すると、肝臓、腎臓、膵臓において、PK-LC3由来の蛍光ドットが増加しました。脳組織内では、大脳皮質、海馬CA1領域(*6)、歯状回(*7)、小脳プルキンエ層(*8)、小脳核、脊髄、いずれの神経細胞においても、オートファジーを誘導することでPK-LC3由来の蛍光ドットが増加していました(図2)。
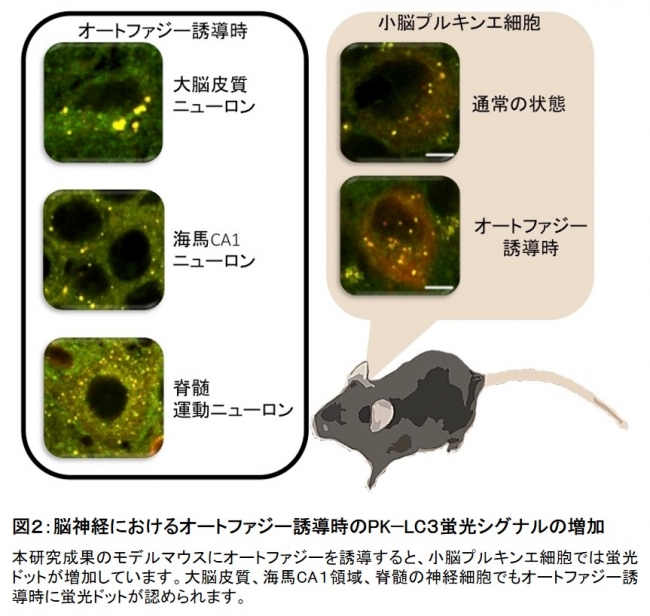 図2:脳神経におけるオートファジー誘導時のPK−LC3蛍光シグナルの増加
図2:脳神経におけるオートファジー誘導時のPK−LC3蛍光シグナルの増加
今後の展開
老化や神経変性疾患の多くは、数十年の時を経て起こります。そのため、老化や神経変性疾患におけるオートファジーを評価・解明するためには、個体レベルで長期間(数ヶ月から数年)オートファジー機能を評価できるモデルマウスが必要です。しかし、これまではモデルマウスが存在しないことから、培養神経細胞を用いたり脳内にウイルスベクター(*9)を感染させてオートファジーを検出する手法に限定されていました。本研究で開発したPK-LC3tgマウスは、神経変性疾患として知られる“分解されない物質が神経細胞内に溜まる難病(パーキンソン病、アルツハイマー病、プリオン病、バッテン病、筋萎縮性側索硬化症など)”や老化に伴う脳神経内オートファジーの機能低下の研究を加速するための強力なツールとなることが期待されます。今後、老化・神経変性疾患による経時的な脳神経内オートファジーの変化を解析するとともに、将来的には脳神経内オートファジーの抑制を指標とした、老化や神経変性疾患に対する治療薬開発につながることが期待されます。
用語解説
*1 オートファジー:細胞内バルク分解システムで神経変性疾患や腫瘍化など多くの疾患に関与。オートファジーの研究で大隅良典博士がノーベル賞受賞。
*2 バッテン病(神経セロイドリポフスチン症):常染色体劣性遺伝性リソソーム病のひとつ。乳幼児期から小児期にかけて神経系の障害として発症する進行性の遺伝性神経変性疾患。
*3 蛍光プローブ:蛍光タンパク質の蛍光を利用して、生命現象を可視化するツール。
*4 オートファゴソーム:オートファジーが誘導されると形成される、分解するべき細胞質を取り囲む膜構造体。オートファゴソームが形成された時点では内包物の分解はまだ起こっていない。
*5 オートリソソーム:オートファゴソームにリソソームが融合し、分解酵素による内包物の分解が起こる。
*6 海馬CA1領域:海馬は大脳辺縁系の一部である海馬体の一部で脳の記憶や空間学習能力に関与。海馬の錐体細胞層はCA1、CA2、CA3に分類される。CAはフランスの解剖学者Garengeotが1742年に「エジプトの太陽神アモン神の角(アンモン角)(Cornu Ammonis)」と命名したことが由来。
*7 歯状回:海馬とともに海馬体の一部。海馬歯状回とも呼ばれる。記憶や学習といった脳高次機能に関与。
*8 小脳プルキンエ層:小脳皮質内のプルキンエ細胞が形成している層。運動制御及び運動学習・運動記憶に関与
*9 ウイルスベクター:遺伝子操作により、複製や増殖能を欠失させたウイルスをもちいて遺伝物質を細胞内に輸送するためのツール。
原著論文
本研究はScientific Reports誌に(2020年6月15日付)公開されました。
タイトル: Characterization of starvation-induced autophagy in cerebellar Purkinje cells of pHluorin-mKate2-human LC3B transgenic mice.
タイトル(日本語訳): pHluorin-mKate2-human LC3B トランスジェニックマウスのプルキンエ細胞におけるオートファジーの解析
著者:Juan Alejandro Oliva Trejo, Isei Tanida, Chigure Suzuki, Soichiro Kakuta, Norihiro Tada, and Yasuo Uchiyama
著者(日本語表記):オリバ トレホ・アレハンドロ1、谷田以誠1、鈴木ちぐれ1、角田宗一郎1、多田昇弘2、内山安男1
著者所属:1 順天堂大学大学院医学研究科神経疾患病態構造学講座、2 順天堂大学大学院医学研究科アトピー疾患研究センター
DOI: 10.1038/s41598-020-66370-6
本研究は国立研究開発法人日本医療研究開発機構(AMED)「老化メカニズム解明・制御プロジェクト」研究費 (18gm5010003)、文部科学省私立大学戦略的研究基盤形成事業、日本学術振興会(JSPS)科研費(JP15K12749)、順天堂大学老人性疾患病態・治療研究センター研究奨励費の支援を受けて、実施されました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
