IgA腎症の炎症を引き起こす鍵となる分子を同定
~ AIMの制御がIgA腎症の進行予防および治療法開発のターゲットとなる可能性 ~
順天堂大学医学部腎臓内科学講座の髙畑暁子 非常勤助教、鈴木祐介 教授らの研究グループは、東京大学大学院医学系研究科疾患生命工学センター分子病態医科学部門の宮崎徹 教授らとの共同研究により、IgA腎症(*1)の炎症を引き起こす鍵となる分子を同定しました。IgA腎症において、免疫グロブリンのIgA蛋白が糸球体に沈着するだけでは腎炎は発症せず、AIM(apoptosis inhibitor of macrophage*2)を介してIgAと他の免疫グロブリンIgGおよびIgMとの共沈着が生じることで腎炎が発症・進展することを発見しました。この成果は、AIMの制御がIgA腎症の進行予防および治療法開発のターゲットとなる可能性を示しており、IgA腎症の新薬開発につながることが期待されます。本研究は、英科学雑誌Journal of the American Society of Nephrologyに掲載されました。
本研究成果のポイント
IgA腎症とは、腎臓の糸球体に異常なIgAが沈着して炎症が起こる疾患で、糸球体腎炎の多くを占めており、国内では約3万人の患者がいます。未治療の場合、発症から約20年で約4割が末期腎不全(透析を必要とする状態)に至りますが、糸球体にIgAが沈着することによりどのように炎症が起きていくのかはまだ解明されておらず、確立した治療法もまだありません。一方、最近の研究でAIMが白血球の一種であるマクロファージ(*3)の機能を介して腎障害の病態に関わっていることが明らかになってきました。そこで今回、研究グループは、IgA腎症におけるIgA沈着による炎症発生のメカニズムとAIMの関わりを解明する目的で研究を行いました。
内容
研究グループは先行研究において、ヒトIgA腎症およびIgA腎症自然発症モデルマウスの糸球体には、IgAと同じ個所にAIMの沈着があることを発見しました。今回、IgA腎症とAIMの関わりをさらに詳しく解明するために、AIM欠損マウスおよびIgA欠損マウスを新たに作製し、解析を行いました。遺伝子編集技術であるCRISPR-Cas9システム(*4)を用いてIgA腎症自然発症モデルマウスでAIMを欠損させた結果、糸球体へのIgAの沈着を認めるものの、その他の所見は認めず腎症が発症しないことが分かりました。続いて、同マウスにAIMを投与したところ、糸球体にIgGとIgMが共沈着して尿蛋白・尿潜血が出現し、腎症を発症することが確認されました。このことから、糸球体へのIgA沈着だけでは腎症に進展しないことが明らかになりました(図1)。また、IgAを欠損したマウスでは、糸球体にAIM、IgG、IgMの沈着が誘導されませんでした。
今後の展開
今回、AIMがIgA腎症の炎症発生の起点となる鍵の分子であることを発見しました。この成果は、AIMの制御がIgA腎症の進行予防および治療法開発のターゲットとなる可能性を示しています。IgA腎症の病因にはIgAの糖鎖修飾異常が深く関わることがわかっており、この糖鎖異常IgAとAIMの結合機序の解明も今後重要な課題となります。また、AIMを介したIg免疫複合体が血清や腎糸球体でどのように形成されるのかについても、さらなる研究が必要です。これらの結合機序が解明されれば、結合予防や結合解離を促すIgA腎症の新たな新薬開発が期待されます。
用語解説
*1 IgA腎症:腎臓の糸球体に異常なIgAが沈着して炎症が起こる疾患で、糸球体腎炎の多くを占めており、国内では約3万人の患者がいる。
*2 AIM(apoptosis inhibitor of macrophage):当初マクロファージから分泌され、細胞のアポトーシス(細胞死)を抑制する分子として東京大学大学院医学系研究科の宮崎徹教授が発見したもの。近年の研究でAIMはマクロファージを介して様々な全身の疾患に関わることが明らかとなった。
*3 マクロファージ:白血球の一種で全身に広く分布しており、死んだ細胞、体内に生じた変性物質や侵入した細菌などの異物を食べる働きがある。
*4 CRISPR-Cas9システム:DNA二本鎖を切断してゲノム配列の任意の場所を削除、置換、挿入することができる新しい遺伝子改変技術。
*5 補体(C3):生体が病原体を排除する際に抗体および貪食細胞を補助するという意味で命名された免疫システム (補体系) を構成するタンパク質。C3は補体の第3成分。
原著論文
本研究はJournal of the American Society of Nephrology誌の2020年8月発刊、31巻8号に掲載されました。
タイトル: Crucial Role of AIM/CD5L in the Development of Glomerular Inflammation in IgA Nephropathy
タイトル(日本語訳):IgA腎症における腎糸球体の炎症起点に関わるAIM/CD5Lの重要な働き
著者:Akiko Takahata1, Satoko Arai2, Emiri Hiramoto2, Kento Kitada2,3, Rina Kato1, Yuko Makita1, Hitoshi Suzuki1, Junichiro Nakata1, Kimi Araki 4, Toru Miyazaki2,5 and Yusuke Suzuki1
著者(日本語表記):髙畑暁子1, 新井郷子2, 平本絵美莉2, 北田研人2,3, 加藤莉那1, 牧田侑子1, 鈴木 仁1,中田 純一郎1, 荒木喜美4, 宮崎 徹2,5, 鈴木祐介1
著者所属:1) 順天堂大学腎臓内科学講座、2) 東京大学大学院医学系研究科 疾患生命工学センター分子病態医科学部門 3) Cardiovascular and Metabolic Disorders, Duke-NUS Medical School、4) 熊本大学 生命資源研究・支援センター 疾患モデル分野、5) 日本医療研究開発機構 (LEAP)
DOI: https://doi.org/10.1681/ASN.2019100987
本研究は、JSPS科研費(JP16H06389およびJP26461237)、 AMED-CREST(JP18gm0610009)、AMED-LEAP (20gm0010006s0102)、厚生労働科学研究費補助金難治性疾患政策研究事業 (20FC1045)、協和発酵キリン、MSD Co., Ltd.、Boehringer Ingelheimの助成を受け実施されました。
- IgA腎症モデルマウスにAIMを欠損させるとIgA腎症は起こらなかった
- AIMを欠損したIgA腎症モデルマウスにAIMを投与するとIgA腎症を発症した
- AIMの制御がIgA腎症の進行予防および治療法開発のターゲットとなる可能性
IgA腎症とは、腎臓の糸球体に異常なIgAが沈着して炎症が起こる疾患で、糸球体腎炎の多くを占めており、国内では約3万人の患者がいます。未治療の場合、発症から約20年で約4割が末期腎不全(透析を必要とする状態)に至りますが、糸球体にIgAが沈着することによりどのように炎症が起きていくのかはまだ解明されておらず、確立した治療法もまだありません。一方、最近の研究でAIMが白血球の一種であるマクロファージ(*3)の機能を介して腎障害の病態に関わっていることが明らかになってきました。そこで今回、研究グループは、IgA腎症におけるIgA沈着による炎症発生のメカニズムとAIMの関わりを解明する目的で研究を行いました。
内容
研究グループは先行研究において、ヒトIgA腎症およびIgA腎症自然発症モデルマウスの糸球体には、IgAと同じ個所にAIMの沈着があることを発見しました。今回、IgA腎症とAIMの関わりをさらに詳しく解明するために、AIM欠損マウスおよびIgA欠損マウスを新たに作製し、解析を行いました。遺伝子編集技術であるCRISPR-Cas9システム(*4)を用いてIgA腎症自然発症モデルマウスでAIMを欠損させた結果、糸球体へのIgAの沈着を認めるものの、その他の所見は認めず腎症が発症しないことが分かりました。続いて、同マウスにAIMを投与したところ、糸球体にIgGとIgMが共沈着して尿蛋白・尿潜血が出現し、腎症を発症することが確認されました。このことから、糸球体へのIgA沈着だけでは腎症に進展しないことが明らかになりました(図1)。また、IgAを欠損したマウスでは、糸球体にAIM、IgG、IgMの沈着が誘導されませんでした。
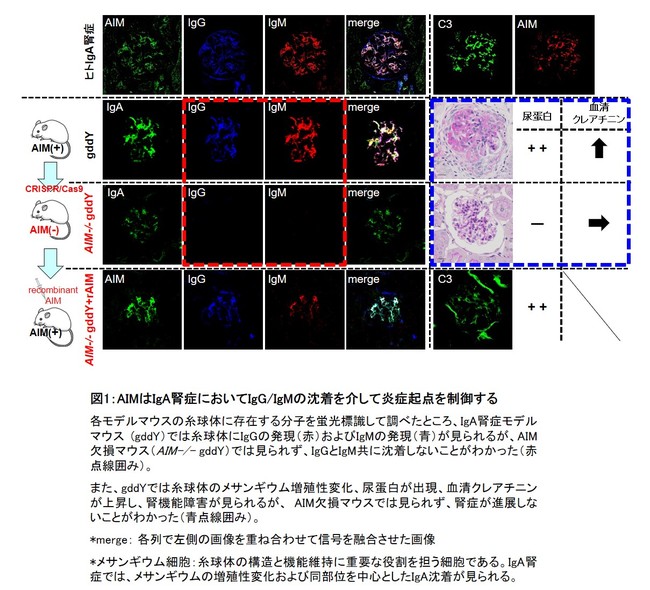 図1:AIMはIgA腎症においてIgG・IgMの沈着を介して炎症起点を制御する
図1:AIMはIgA腎症においてIgG・IgMの沈着を介して炎症起点を制御する
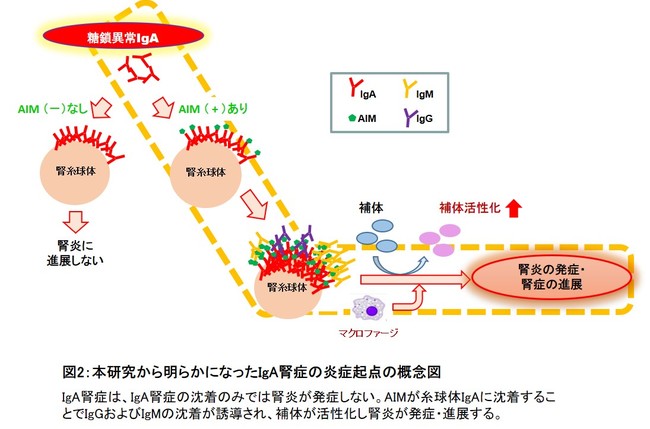 図2:本研究から明らかになったIgA腎症の炎症起点の概念図
図2:本研究から明らかになったIgA腎症の炎症起点の概念図
今後の展開
今回、AIMがIgA腎症の炎症発生の起点となる鍵の分子であることを発見しました。この成果は、AIMの制御がIgA腎症の進行予防および治療法開発のターゲットとなる可能性を示しています。IgA腎症の病因にはIgAの糖鎖修飾異常が深く関わることがわかっており、この糖鎖異常IgAとAIMの結合機序の解明も今後重要な課題となります。また、AIMを介したIg免疫複合体が血清や腎糸球体でどのように形成されるのかについても、さらなる研究が必要です。これらの結合機序が解明されれば、結合予防や結合解離を促すIgA腎症の新たな新薬開発が期待されます。
用語解説
*1 IgA腎症:腎臓の糸球体に異常なIgAが沈着して炎症が起こる疾患で、糸球体腎炎の多くを占めており、国内では約3万人の患者がいる。
*2 AIM(apoptosis inhibitor of macrophage):当初マクロファージから分泌され、細胞のアポトーシス(細胞死)を抑制する分子として東京大学大学院医学系研究科の宮崎徹教授が発見したもの。近年の研究でAIMはマクロファージを介して様々な全身の疾患に関わることが明らかとなった。
*3 マクロファージ:白血球の一種で全身に広く分布しており、死んだ細胞、体内に生じた変性物質や侵入した細菌などの異物を食べる働きがある。
*4 CRISPR-Cas9システム:DNA二本鎖を切断してゲノム配列の任意の場所を削除、置換、挿入することができる新しい遺伝子改変技術。
*5 補体(C3):生体が病原体を排除する際に抗体および貪食細胞を補助するという意味で命名された免疫システム (補体系) を構成するタンパク質。C3は補体の第3成分。
原著論文
本研究はJournal of the American Society of Nephrology誌の2020年8月発刊、31巻8号に掲載されました。
タイトル: Crucial Role of AIM/CD5L in the Development of Glomerular Inflammation in IgA Nephropathy
タイトル(日本語訳):IgA腎症における腎糸球体の炎症起点に関わるAIM/CD5Lの重要な働き
著者:Akiko Takahata1, Satoko Arai2, Emiri Hiramoto2, Kento Kitada2,3, Rina Kato1, Yuko Makita1, Hitoshi Suzuki1, Junichiro Nakata1, Kimi Araki 4, Toru Miyazaki2,5 and Yusuke Suzuki1
著者(日本語表記):髙畑暁子1, 新井郷子2, 平本絵美莉2, 北田研人2,3, 加藤莉那1, 牧田侑子1, 鈴木 仁1,中田 純一郎1, 荒木喜美4, 宮崎 徹2,5, 鈴木祐介1
著者所属:1) 順天堂大学腎臓内科学講座、2) 東京大学大学院医学系研究科 疾患生命工学センター分子病態医科学部門 3) Cardiovascular and Metabolic Disorders, Duke-NUS Medical School、4) 熊本大学 生命資源研究・支援センター 疾患モデル分野、5) 日本医療研究開発機構 (LEAP)
DOI: https://doi.org/10.1681/ASN.2019100987
本研究は、JSPS科研費(JP16H06389およびJP26461237)、 AMED-CREST(JP18gm0610009)、AMED-LEAP (20gm0010006s0102)、厚生労働科学研究費補助金難治性疾患政策研究事業 (20FC1045)、協和発酵キリン、MSD Co., Ltd.、Boehringer Ingelheimの助成を受け実施されました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
