ヒスタミンH3受容体の恒常的活性を制御する構造決定因子を解明 ~GPCR研究の進展と新たな神経疾患治療薬開発に一歩前進~
【研究の要旨とポイント】
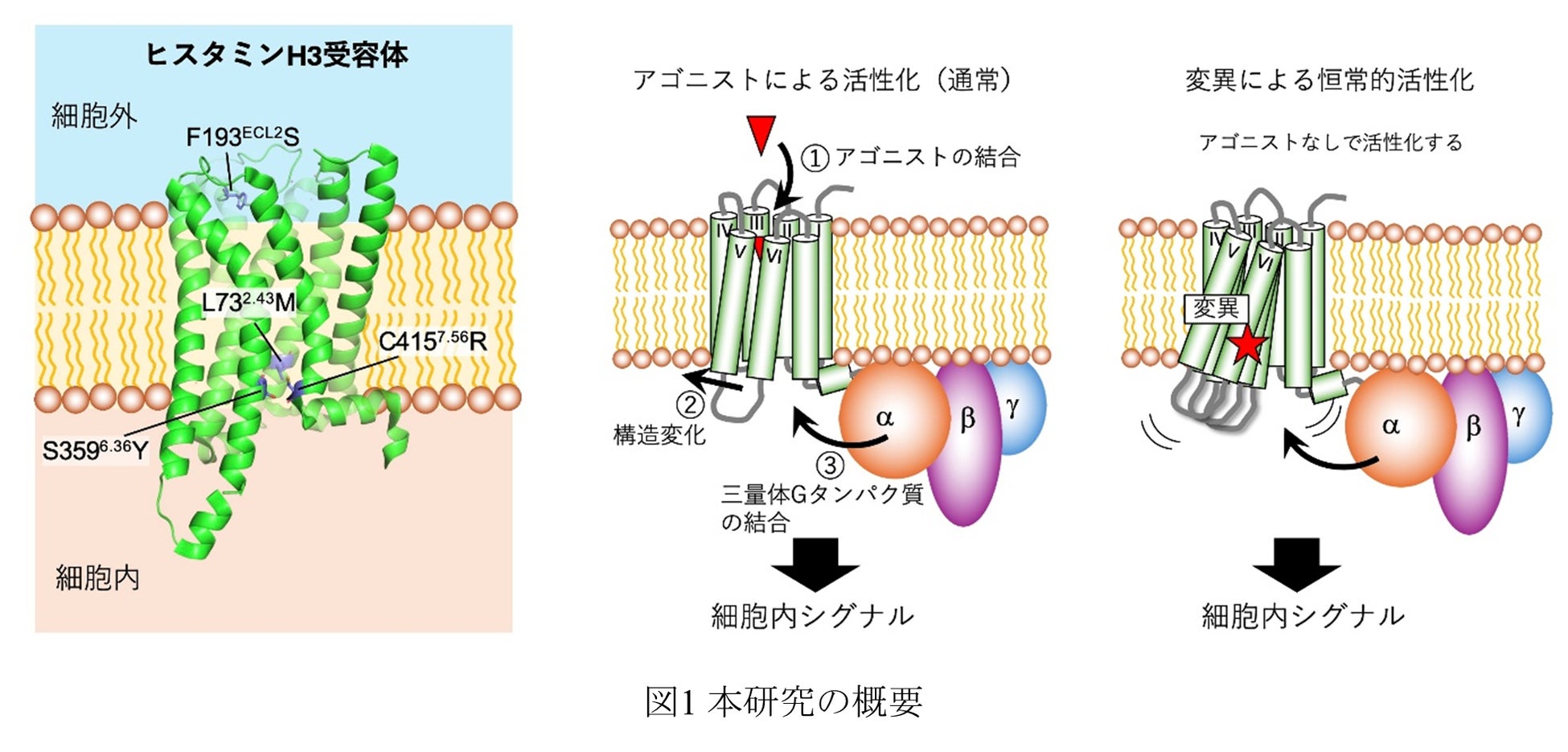
Gタンパク質共役型受容体(GPCR)の一種であるヒスタミンH3受容体(H3R)において、4つのアミノ酸変異(L732.43M、F193ECL2S、S3596.36Y、C4157.56R)が恒常的活性を著しく増強することを明らかにしました。
恒常的活性の増強は受容体の構造的な不安定化と密接に関連していることを実験的に明らかにしました。
本研究成果をさらに発展させることにより、GPCR全般の活性化理解や新薬開発への応用につながることが期待されます。
【研究の概要】
東京理科大学 先進工学部 生命システム工学科の白石 充典教授、小山 浩舗助教、同大学大学院 先進工学研究科 生命システム工学専攻の中島 愛海氏(2024年度 修士課程修了)、金子 大斗氏(2025年度 博士課程1年)らの研究グループは、Gタンパク質共役型受容体(GPCR)の一種であるヒスタミンH3受容体(H3R)について、アミノ酸変異による受容体の構造的な不安定化がその恒常的活性化(*1)につながることを実験的に実証しました。
H3Rは中枢神経系に発現し、複数の神経疾患の治療ターゲットとして注目されています。H3Rは本質的に高い恒常的活性を示しますが、その活性を制御する構造決定因子はほとんど解明されていません。本研究グループは過去に、出芽酵母(Saccharomyces cerevisiae)で発現させても活性が見られなかったH3Rにおいて、活性の回復に寄与する4つのアミノ酸変異(L732.43M、F193ECL2S、S3596.36Y、C4157.56R)を同定していました(※1)。しかし、これらの変異がどのような機構で受容体活性に影響しているか、その詳細については未解明のままでした。
本研究では、出芽酵母を用いた二重変異体実験から、4つの活性回復変異(L732.43M、F193ECL2S、S3596.36Y、C4157.56R)がH3Rの恒常活性を著しく増強することを実証しました。また哺乳類細胞を用いた実験では、単独の変異でも恒常的活性が増強されることが確認されました。重要なことに、放射性標識リガンド結合実験(*2)により、これらの変異はヒスタミンへの結合親和性を変えずに活性化を促進することが明らかになりました。また、FSEC/FSEC-TS解析(*3)により、恒常的活性の増強が受容体の構造不安定化と密接に関連していることが実証されました。膜貫通領域の3つの変異(L732.43M、S3596.36Y、C4157.56R)は立体的衝突により、F193ECL2S変異は芳香族相互作用の消失により熱安定性が低下することがわかりました。
さらに、H3RのC4157.56R変異をH1受容体(H1R)に導入するとEC50値(*4)における効果が約100倍向上しましたが、他の変異はほとんど効果を示さず、GPCR間での保存性と受容体特異性の両方が存在することが明らかになりました。
本研究成果は、2025年12月22日に国際学術誌「Protein Science」にオンライン掲載されました。
【研究の背景】
ヒスタミンH3受容体(H3R)は中枢神経系の前頭葉に主に発現するクラスAのGタンパク質共役型受容体(GPCR)であり、神経伝達物質の放出を抑制します。食欲調節、注意欠如・多動症(ADHD)、統合失調症、脳血症、パーキンソン病、アルツハイマー病などさまざまな神経疾患に関与しており、有望な治療ターゲットとされています。
H3Rは本質的に高い恒常的活性を示し、特定のアミノ酸置換によりそれがさらに上昇することが知られています。また、アンタゴニスト(拮抗薬)との結晶構造やヘテロ三量体Giタンパク質と複合したクライオ電子顕微鏡構造が解明されていますが、活性化を促進する分子メカニズムや、H3Rの恒常的活性を制御する構造決定因子についてはほとんど解明されていません。
本研究グループは、以前に出芽酵母(S. cerevisiae)で同定された4つの活性回復変異(L732.43M、F193ECL2S、S3596.36Y、C4157.56R)について、それぞれ単独でリガンド依存的な活性を回復させることを確認しており(※1)、これらの変異がH3Rを活性型へ移行させやすくすると仮説を立てました。そこで本研究では、これらの二重変異体を作製しシグナル伝達活性やヒスタミンへの結合親和性を測定し、受容体の構造安定性を評価しました。これにより、H3Rの恒常活性を制御する構造決定因子と、その分子メカニズムの解明を目指しました。
※1: 東京理科大学プレスリリース(2023年10月19日付)
『出芽酵母を利用した発現系でヒト由来ヒスタミンH3受容体の活性回復に成功 ~重要な創薬ターゲットであるGタンパク質共役型受容体の機構解明に貢献~』
【研究結果の詳細】
4つの変異(L732.43M、F193ECL2S、S3596.36Y、C4157.56R)のすべての組み合わせについて二重変異体を作製し、出芽酵母を用いてシグナル伝達活性を評価しました。その結果、すべての二重変異体で恒常的活性が著しく増加し、一部ではEC50値の減少も観察されました。これらの結果は、変異が協調的に作用してH3Rの活性型構造への移行を促進することを示唆しています。また哺乳類細胞を用いた実験では、単独で変異導入した4つの変異体すべてにおいて、野生型受容体と比較してより高いGi活性を示しましたが、細胞表面発現レベルに有意差はありませんでした。この結果は、哺乳類細胞における発現量の違いではなく、受容体自体の性質の変化によるものであることを示しており、これらの変異がH3Rの恒常的活性を増強することが実証されました。
FSEC/FSEC-TS解析を用いて、4つの変異がH3Rの構造をどのように変化させるかを調べました。その結果、すべての変異がH3Rを不安定にすることがわかりました。膜貫通領域の3つの変異(L732.43M、S3596.36Y、C4157.56R)は受容体内部で立体的な衝突を起こし、細胞外ループの変異(F193ECL2S)は周囲の残基との相互作用(カチオン-π相互作用、π-π相互作用、疎水性相互作用など)を消失させることで、それぞれ受容体を不安定化させていました。これらの結果から、H3Rでは受容体を構造的に不安定にすることが恒常的活性の増強につながるという重要な原理が明らかになりました。
さらに、配列の類似性が約22%と低いH1受容体(H1R)にC4157.56R変異を導入したところ、その効果が約100倍も向上しました。これは、受容体が異なっても特定の変異が同じように作用できることを示しています。しかし、他の変異(L732.43MやS3596.36Y)はH1Rでほとんど効果を示しませんでした。これは、変異の効果がその周囲の局所的な構造環境に大きく依存することを意味しており、GPCR活性化における普遍的な原理と受容体特異的なメカニズムの両方が重要であることが明らかになりました。
本研究を主導した白石教授は、「以前私たちは、出芽酵母で発現させても活性がなかったH3Rに活性を付与する変異を発見しました。これらの変異が受容体に及ぼす影響を深く調べようと思い、本研究に至りました。本研究は将来的に脳の病気の理解や、より安全な薬の設計につながる基礎となるものであると考えています。さらに、人工的なGPCRの設計にも役立つ情報となりえます」と、コメントしています。
-
本研究は、日本学術振興会(JSPS)の科研費(JP25709080, JP15K14460)、文部科学省(MEXT)および国立研究開発法人 日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)、公益財団法人 加藤記念バイオサイエンス振興財団の助成を受けて実施されました。
【用語】
*1 恒常的活性
受容体は通常、リガンド(作動薬)が結合することで活性化し、細胞内にシグナル伝達を行う。一方、恒常的活性をもつ受容体は、リガンド非存在下でも自発的に活性化状態をとり、基礎的なシグナル伝達を行う。
*2 放射性標識リガンド結合実験
放射性同位体(本研究では三重水素[3H])で標識したリガンド(ヒスタミン)を用いて、受容体への結合の強さを定量的に評価する手法。リガンドの濃度を変えながら受容体との結合量を測定し、解離定数(Kd値)を算出することで、受容体とリガンドの親和性(結合のしやすさ)を数値化できる。
*3 FSEC(蛍光検出サイズ排除クロマトグラフィー)
蛍光タンパク質(GFP)を目印として受容体の安定性や単量体・オリゴマー状態を評価する手法。FSEC-TS(熱安定性シフトアッセイ)は、さまざまな温度で加熱した後にFSECを行い、受容体の熱安定性を測定する手法。単量体ピークが消失して高分子量種にシフトすると、受容体が不安定化してオリゴマー化(凝集)していることを示す。
*4 EC50(50%効果濃度)
薬物や化学物質が最大効果の50%を示すために必要な濃度。
【論文情報】

|
雑誌名 |
:Protein Science |
|
論文タイトル |
:Activity-restoring mutations in the histamine H3 receptor increase constitutive activity and reduce structural stability |
|
著者 |
:Ami Nakajima, Hiroto Kaneko, Kosuke Oyama, Misumi Kuchiji, Ayane Itakura, Chiaki Arai, Mitsunori Shiroishi |
|
DOI |
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20260116_1699.html)をご参照ください。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
