希少がん「平滑筋肉腫」の原因となる発がん因子を新たに発見
~ トランスクリプトーム解析を用いたがん個別化医療の開発へ ~
順天堂大学医学部整形外科学講座の末原義之 准教授、および人体病理病態学講座の林大久生 准教授、齋藤剛 准教授らの研究グループは、国立がん研究センターとの共同研究により、希少がんである軟部肉腫(*1)の一種「平滑筋肉腫」に対しトランスクリプトーム解析(*2)を行い、チロシンキナーゼ融合遺伝子(*3)に属するMAN1A1/ROS1融合遺伝子を発がん因子として同定することに成功しました。さらに、肺がんの抗がん剤として用いられるクリゾチニブ(*4)が平滑筋肉腫の標的治療薬になりうることを見出しました。今回の研究で軟部肉腫における新規チロシンキナーゼ融合遺伝子治療標的を明らかに出来たことで、がんゲノム医療(*5)時代における進行軟部肉腫の個別化医療の開発に大きく道を拓く可能性を示しました。本研究は米国の整形外科治療の科学誌「Clinical Orthopaedics and Related Research 」オンライン版で発表されました。
本研究成果のポイント
背景
軟部肉腫は国内で年間1500名ほどに発生する悪性腫瘍で、発生頻度の低さより希少がんに分類されます。様々な年齢層に発生しますが、近年では高齢者に多く発生する傾向がみられます。治療には化学療法、外科手術、放射線治療を組み合わせた治療が行われていますが、化学療法は今のところ30年以上前より使用されてるアドリアマイシンの奏効性(*6)を越えるものがなく、二次治療に用いる新規薬剤(パゾパニブ、エリブリン、トラベクテジンなど)でも奏効性が低いことが課題です。また、転移症例では5年生存率が30%以下と極めて悪性度が高いものが多く、新たな治療法開発が必要とされています。昨今がんクリニカルシークエンス検査(*7)による希少がんの診断や治療が進んでいますが、主に用いられるDNAパネル(*8)では、治療に有効な標的であるチロシンキナーゼ融合遺伝子の同定率が低いことが課題でした。今回、研究グループは、患者ゲノム情報を解析するがんクリニカルシークエンス法に加えて、トランスクリプトームレベル(RNAや塩基配列の解析)で遺伝子発現の均衡状態を網羅的に解析することで新たな治療標的を明らかにし、進行軟部肉腫の新規個別化医療を開発することを目的として研究を進めました。
内容
今回、研究グループは、順天堂大学医学部附属順天堂医院及び共同研究機関で治療した24例の進行軟部肉腫(平滑筋肉腫15例、悪性末梢神経鞘腫瘍5例、高悪性粘液線維肉腫4例)の手術検体の腫瘍部におけるがんの原因となるチロシンキナーゼ遺伝子の全てに対し、トランスクリプトームレベルの遺伝子発現の不均一性を指標とした網羅的な探索を、米国で開発された遺伝子発現解析システム「NanoString nCounter(*9)」を用いて行いました。その結果、新規チロシンキナーゼ融合遺伝子として発見したMAN1A1/ROS1融合遺伝子を(1/15例(7%)の)平滑筋肉腫の発がん因子として同定することに成功しました(図1)。
今後の展開
本研究により進行軟部肉腫の新規チロシンキナーゼ治療標的を明らかにできたことで、進行軟部肉腫の個別化医療の開発が進むことが期待されます。また、現在国内外のがんゲノム医療で進められているDNAパネルを用いたがんクリニカルシークエンス検査に、トランスクリプトームレベルでの遺伝子解析による補助検査を追加することで、進行軟部肉腫の新たな治療標的を発見できる臨床的な有益性が認められました。順天堂医院で2016年に導入した世界最高精度のがんクリニカルシークエンス検査(MSK-IMPACT)では、468個にのぼるがん関連遺伝子のDNAパネルによる遺伝子変化の解析とRNAパネルによるトランスクリプトームレベルでの補助的検査が可能です。今回、 NanoString nCounterを用いることでトランスクリプトーム解析の有用性が確認できたため、今後はより精度の高いMSK-IMPACTを用いた臨床試験によりさらに検証を重ねることで、希少がん軟部肉腫に対して一歩進んだ個別化医療を展開していきます。
用語解説
*1.軟部肉腫: 臓器と骨や皮膚を除く、筋肉、腱、脂肪、血管、リンパ管、関節、神経を軟部組織といい、 軟部肉腫は軟部組織に発生する悪性腫瘍で、体のいろいろな部位に発生する。発生頻度が低く希少がんに分類される。軟部肉腫のひとつの組織型に平滑筋肉腫がある。
*2.トランスクリプトーム解析: トランスクリプトームは特定の状況下において細胞中に存在する全てのmRNA(ないしは一次転写産物)の総体を指す呼称。トランスクリプトーム解析とはそれらmRNAの発現や塩基配列を(遺伝子)解析すること。
*3.チロシンキナーゼ融合遺伝子: アミノ酸の一つであるチロシンにリン酸を付加する酵素で細胞の増殖・分化に重要な役割を持つ。遺伝子変異によってチロシンキナーゼが異常に活性化すると、細胞が異常に増殖し、癌の原因となる。チロシンキナーゼ融合遺伝子はチロシンキナーゼと他の遺伝子と融合した変異があり活性化することで癌を引き起こす。肺がんなどではALK, ROS1, RET融合遺伝子などが同定されているおり、発癌因子(driver-oncogene)とされ、それらを治療標的としたチロシンキナーゼ阻害剤は高い奏効性を示す。
*4. クリゾチニブ(Crizotinib) : マルチキナーゼ阻害薬であり、ALK融合遺伝子陽性の進行非小細胞肺癌やROS1融合遺伝子陽性の進行非小細胞肺癌の転移治療に用いられる。
*5.ゲノム医療: プレシジョン・メディシンとも呼ばれる。近年、分子標的薬が多数開発されており、検出された遺伝子変化に応じて分子標的薬を精密に選択する個別化医療。
*6.奏効性: 癌では化学療法や分子標的治療などで癌縮小効果などが現れること。
*7.がんクリニカルシークエンス検査: がん関連遺伝子の遺伝子変化を解析し、がん患者の診断や治療に活用する検査。遺伝子に生じている遺伝子変化は患者(腫瘍)ごとに異なり、その遺伝子変化を調べることで個別化した治療(標的治療など)を行える。がんクリニカルシークエンス検査では、通常100を超えるがん関連遺伝子の変化を一度に調べることができ、難治性のがんの診断や治療に役立つ情報がないかを解析することができる。米国屈指のがん拠点施設でニューヨークにあるMemorial Sloan Ketteringがんセンターが開発したがんクリニカルシークエンス検査であるMSK-IMPACTや企業ベースのFoundationOne® CDx などが有名である。MSK-IMPACT検査はFDAの承認を得ており、468個にのぼるがん関連遺伝子の遺伝子変化を調べることができる世界最高精度の検査。国内では順天堂大学医学部附属順天堂医院などで検査可能となっている。
*8. DNAパネル: DNAパネルは一度に複数の遺伝子変異を検出する方法で、がんクリニカルシークエンス検査の現在の国内外の主流はDNAパネルとなっている。しかしながら、DNAパネルは最も治療に有効な標的であるチロシンキナーゼ融合遺伝子同定に対して、極めて同定率が低い問題点が指摘されている(Benayed R, Ladanyi M et al. Clin Cancer Res 2019)。 そのためMSK-IMPACT検査は現在RNAパネルによる補助的検査を追加してるが、他の多くのがんクリニカルシークエンス検査はそれら補助検査追加は行っていない。
*9. NanoString nCounter: 米国 NanoString® Technologies社が開発した遺伝子発現解析システム。特殊な蛍光分子バーコードを持つ配列特異的なプローブを用いることで 、最大800種類の標的配列のデジタル検出が可能。
原著論文
本研究成果は、米国のがん治療の科学雑誌の「Clinical Orthopaedics and Related Research」誌のオンライン版(2020年11月12日付)で公開されました。
論文タイトル:Identification of a novel MAN1A1-ROS1fusion gene through mRNA-based screening for tyrosine kinase gene aberrations in leiomyosarcoma.
日本語訳:チロシンキナーゼ遺伝子異常のmRNAベーススクリーニングによる新規MAN1A1/ROS1融合遺伝子の平滑筋肉腫における同定
著者:Yoshiyuki Suehara, Shinji Kohsaka, Takuo Hayashi, Keisuke Akaike, Akio Kurisaki-Arakawa, Shingo Sato, Eisuke Kobayashi, Sho Mizuno, Toshihide Ueno, Takeshi Morii, Tomotaka Okuma, Taisei Kurihara, Nobuhiko Hasegawa, Kei Sano, Keita Sasa, Taketo Okubo, Youngji Kim, Tsuyoshi Saito, Hiroyuki Mano , Tsuyoshi Saito
著者(日本語表記):末原義之1, 高阪真路2, 林大久生1,赤池慶祐1, 栗崎愛子1,佐藤信吾3,小林英介2,水野祥2,上野 敏秀2,森井健司4,大隈 知威5,栗原大聖1, 長谷川延彦1,佐野圭1, 佐々慶太1,大久保武人1, 金栄智1, 間野博行2 ,齋藤剛1
所属機関:1. 順天堂大学医学部、2. 国立がん研究センター研究所、3. 東京医科歯科大学、4. 杏林大学、5. 都立駒込病院
DOI: 10.1097/CORR.0000000000001548
なお本研究は、国立がん研究センターとの共同研究として、JSPS科研費 JP19H03789, 19K22694, JP15KK0353, JP19K16753, JP18K15329, JP18K16634、日本医療研究開発機構 JP18am0001009, JP18ck0106252による支援を受けて行われました。
ご協力いただきました皆様に深謝いたします。
- 希少がん軟部肉腫の平滑筋肉腫において原因となる新規のチロシンキナーゼ融合遺伝子を発見
- MAN1A1/ROS1融合遺伝子によってがん化した細胞の増殖を肺がんの抗がん剤クリゾチニブが顕著に抑制
- がんクリニカルシークエンス検査にトランスクリプトーム解析を加えることで進行軟部肉腫の新規治療標的の発見と個別化医療の開発へ
背景
軟部肉腫は国内で年間1500名ほどに発生する悪性腫瘍で、発生頻度の低さより希少がんに分類されます。様々な年齢層に発生しますが、近年では高齢者に多く発生する傾向がみられます。治療には化学療法、外科手術、放射線治療を組み合わせた治療が行われていますが、化学療法は今のところ30年以上前より使用されてるアドリアマイシンの奏効性(*6)を越えるものがなく、二次治療に用いる新規薬剤(パゾパニブ、エリブリン、トラベクテジンなど)でも奏効性が低いことが課題です。また、転移症例では5年生存率が30%以下と極めて悪性度が高いものが多く、新たな治療法開発が必要とされています。昨今がんクリニカルシークエンス検査(*7)による希少がんの診断や治療が進んでいますが、主に用いられるDNAパネル(*8)では、治療に有効な標的であるチロシンキナーゼ融合遺伝子の同定率が低いことが課題でした。今回、研究グループは、患者ゲノム情報を解析するがんクリニカルシークエンス法に加えて、トランスクリプトームレベル(RNAや塩基配列の解析)で遺伝子発現の均衡状態を網羅的に解析することで新たな治療標的を明らかにし、進行軟部肉腫の新規個別化医療を開発することを目的として研究を進めました。
内容
今回、研究グループは、順天堂大学医学部附属順天堂医院及び共同研究機関で治療した24例の進行軟部肉腫(平滑筋肉腫15例、悪性末梢神経鞘腫瘍5例、高悪性粘液線維肉腫4例)の手術検体の腫瘍部におけるがんの原因となるチロシンキナーゼ遺伝子の全てに対し、トランスクリプトームレベルの遺伝子発現の不均一性を指標とした網羅的な探索を、米国で開発された遺伝子発現解析システム「NanoString nCounter(*9)」を用いて行いました。その結果、新規チロシンキナーゼ融合遺伝子として発見したMAN1A1/ROS1融合遺伝子を(1/15例(7%)の)平滑筋肉腫の発がん因子として同定することに成功しました(図1)。
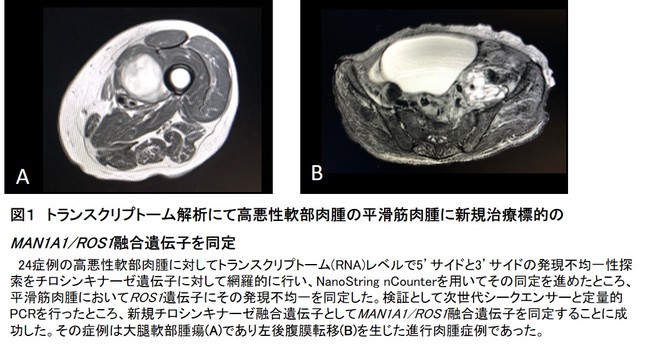 図1 トランスクリプトーム解析にて高悪性軟部肉腫の平滑筋肉腫に新規治療標的のMAN1A1/ROS1融合遺伝子を同定
図1 トランスクリプトーム解析にて高悪性軟部肉腫の平滑筋肉腫に新規治療標的のMAN1A1/ROS1融合遺伝子を同定
さらに、MAN1A1/ROS1融合遺伝子の癌化能を検証したところ、この融合遺伝子は肺がんで既に同定されているCD74/ROS1融合遺伝子より高いことが分かりました。そこで、肺がんの抗がん剤として用いられるマルチキナーゼ阻害薬のクリゾチニブを癌化能を示した細胞株とその腫瘍を持つマウスに使用したところ、がん細胞の増殖を顕著に抑制することを見出しました(図2)。
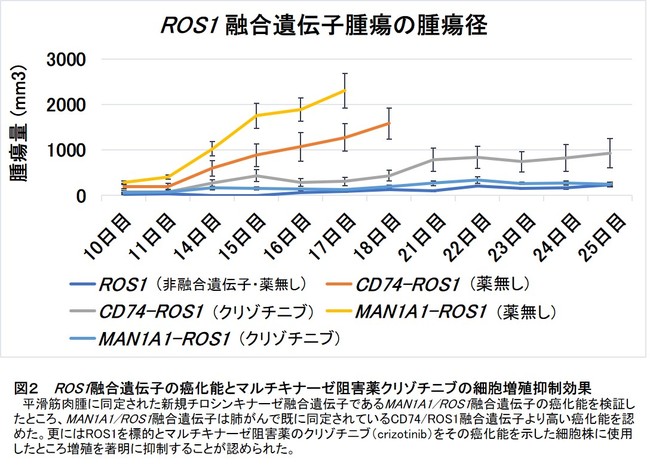 図2 ROS1融合遺伝子の癌化能とマルチキナーゼ阻害薬クリゾチニブの細胞増殖抑制効果
図2 ROS1融合遺伝子の癌化能とマルチキナーゼ阻害薬クリゾチニブの細胞増殖抑制効果
今後の展開
本研究により進行軟部肉腫の新規チロシンキナーゼ治療標的を明らかにできたことで、進行軟部肉腫の個別化医療の開発が進むことが期待されます。また、現在国内外のがんゲノム医療で進められているDNAパネルを用いたがんクリニカルシークエンス検査に、トランスクリプトームレベルでの遺伝子解析による補助検査を追加することで、進行軟部肉腫の新たな治療標的を発見できる臨床的な有益性が認められました。順天堂医院で2016年に導入した世界最高精度のがんクリニカルシークエンス検査(MSK-IMPACT)では、468個にのぼるがん関連遺伝子のDNAパネルによる遺伝子変化の解析とRNAパネルによるトランスクリプトームレベルでの補助的検査が可能です。今回、 NanoString nCounterを用いることでトランスクリプトーム解析の有用性が確認できたため、今後はより精度の高いMSK-IMPACTを用いた臨床試験によりさらに検証を重ねることで、希少がん軟部肉腫に対して一歩進んだ個別化医療を展開していきます。
用語解説
*1.軟部肉腫: 臓器と骨や皮膚を除く、筋肉、腱、脂肪、血管、リンパ管、関節、神経を軟部組織といい、 軟部肉腫は軟部組織に発生する悪性腫瘍で、体のいろいろな部位に発生する。発生頻度が低く希少がんに分類される。軟部肉腫のひとつの組織型に平滑筋肉腫がある。
*2.トランスクリプトーム解析: トランスクリプトームは特定の状況下において細胞中に存在する全てのmRNA(ないしは一次転写産物)の総体を指す呼称。トランスクリプトーム解析とはそれらmRNAの発現や塩基配列を(遺伝子)解析すること。
*3.チロシンキナーゼ融合遺伝子: アミノ酸の一つであるチロシンにリン酸を付加する酵素で細胞の増殖・分化に重要な役割を持つ。遺伝子変異によってチロシンキナーゼが異常に活性化すると、細胞が異常に増殖し、癌の原因となる。チロシンキナーゼ融合遺伝子はチロシンキナーゼと他の遺伝子と融合した変異があり活性化することで癌を引き起こす。肺がんなどではALK, ROS1, RET融合遺伝子などが同定されているおり、発癌因子(driver-oncogene)とされ、それらを治療標的としたチロシンキナーゼ阻害剤は高い奏効性を示す。
*4. クリゾチニブ(Crizotinib) : マルチキナーゼ阻害薬であり、ALK融合遺伝子陽性の進行非小細胞肺癌やROS1融合遺伝子陽性の進行非小細胞肺癌の転移治療に用いられる。
*5.ゲノム医療: プレシジョン・メディシンとも呼ばれる。近年、分子標的薬が多数開発されており、検出された遺伝子変化に応じて分子標的薬を精密に選択する個別化医療。
*6.奏効性: 癌では化学療法や分子標的治療などで癌縮小効果などが現れること。
*7.がんクリニカルシークエンス検査: がん関連遺伝子の遺伝子変化を解析し、がん患者の診断や治療に活用する検査。遺伝子に生じている遺伝子変化は患者(腫瘍)ごとに異なり、その遺伝子変化を調べることで個別化した治療(標的治療など)を行える。がんクリニカルシークエンス検査では、通常100を超えるがん関連遺伝子の変化を一度に調べることができ、難治性のがんの診断や治療に役立つ情報がないかを解析することができる。米国屈指のがん拠点施設でニューヨークにあるMemorial Sloan Ketteringがんセンターが開発したがんクリニカルシークエンス検査であるMSK-IMPACTや企業ベースのFoundationOne® CDx などが有名である。MSK-IMPACT検査はFDAの承認を得ており、468個にのぼるがん関連遺伝子の遺伝子変化を調べることができる世界最高精度の検査。国内では順天堂大学医学部附属順天堂医院などで検査可能となっている。
*8. DNAパネル: DNAパネルは一度に複数の遺伝子変異を検出する方法で、がんクリニカルシークエンス検査の現在の国内外の主流はDNAパネルとなっている。しかしながら、DNAパネルは最も治療に有効な標的であるチロシンキナーゼ融合遺伝子同定に対して、極めて同定率が低い問題点が指摘されている(Benayed R, Ladanyi M et al. Clin Cancer Res 2019)。 そのためMSK-IMPACT検査は現在RNAパネルによる補助的検査を追加してるが、他の多くのがんクリニカルシークエンス検査はそれら補助検査追加は行っていない。
*9. NanoString nCounter: 米国 NanoString® Technologies社が開発した遺伝子発現解析システム。特殊な蛍光分子バーコードを持つ配列特異的なプローブを用いることで 、最大800種類の標的配列のデジタル検出が可能。
原著論文
本研究成果は、米国のがん治療の科学雑誌の「Clinical Orthopaedics and Related Research」誌のオンライン版(2020年11月12日付)で公開されました。
論文タイトル:Identification of a novel MAN1A1-ROS1fusion gene through mRNA-based screening for tyrosine kinase gene aberrations in leiomyosarcoma.
日本語訳:チロシンキナーゼ遺伝子異常のmRNAベーススクリーニングによる新規MAN1A1/ROS1融合遺伝子の平滑筋肉腫における同定
著者:Yoshiyuki Suehara, Shinji Kohsaka, Takuo Hayashi, Keisuke Akaike, Akio Kurisaki-Arakawa, Shingo Sato, Eisuke Kobayashi, Sho Mizuno, Toshihide Ueno, Takeshi Morii, Tomotaka Okuma, Taisei Kurihara, Nobuhiko Hasegawa, Kei Sano, Keita Sasa, Taketo Okubo, Youngji Kim, Tsuyoshi Saito, Hiroyuki Mano , Tsuyoshi Saito
著者(日本語表記):末原義之1, 高阪真路2, 林大久生1,赤池慶祐1, 栗崎愛子1,佐藤信吾3,小林英介2,水野祥2,上野 敏秀2,森井健司4,大隈 知威5,栗原大聖1, 長谷川延彦1,佐野圭1, 佐々慶太1,大久保武人1, 金栄智1, 間野博行2 ,齋藤剛1
所属機関:1. 順天堂大学医学部、2. 国立がん研究センター研究所、3. 東京医科歯科大学、4. 杏林大学、5. 都立駒込病院
DOI: 10.1097/CORR.0000000000001548
なお本研究は、国立がん研究センターとの共同研究として、JSPS科研費 JP19H03789, 19K22694, JP15KK0353, JP19K16753, JP18K15329, JP18K16634、日本医療研究開発機構 JP18am0001009, JP18ck0106252による支援を受けて行われました。
ご協力いただきました皆様に深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
- 種類
- その他
- ダウンロード
