【セミナーご案内】治験薬GMP入門:日米欧三極対応のポイントとGDP対策 7月5日(木)開催 主催:(株)シーエムシー・リサーチ
先端技術情報や市場情報を提供している(株)シーエムシー・リサーチ(千代田区神田錦町: http://cmcre.com/ )では、化学品やバイオ、医薬関連などの市場動向・技術動向のセミナーや書籍発行を行っておりますが、 このたび「治験薬GMP入門:日米欧三極対応のポイントとGDP対策」と題するセミナーを、 講師に橋本光紀 氏 / 医薬研究開発コンサルテイング 代表取締役をお迎えし、2018年7月5日(木)10:30より、 『ちよだプラットフォームスクエア』5階503会議室(千代田区錦町)で開催いたします。 受講料は、 一般:49,000円(税込)、 弊社メルマガ会員:44,000円(税込)、 アカデミック価格は15,000円となっております(受講料には資料代を含みます)。
セミナーの詳細とお申し込みは、 弊社の以下URLをご覧ください!
http://cmcre.com/archives/33104/
質疑応答の時間もございますので、 是非奮ってご参加ください。
セミナーの詳細とお申し込みは、 弊社の以下URLをご覧ください!
http://cmcre.com/archives/33104/
質疑応答の時間もございますので、 是非奮ってご参加ください。
医薬品開発における出発は臨床試験を如何に効率よく進めることが出来るかにかかってます。その為には治験薬を計画通りに供給することが必須でです。治験薬製造に関しては製法が確立していない時期でもあり、設備もマルチ製造設備を使用するケースが主で製造法の取扱いが実験室レベルでの管理に間に合わせている状況がみられます。
しかし、医薬品としての品質は臨床段階からGMPの規制がかかっており、安易な取り扱いはデータの信頼性を損なうばかりでなく開発にブレーキを掛ける事態となることを忘れてはいけません。如何に効率よく治験薬を製造していくべきか、GDPを含めデータの信ぴょう性など多くのチェックポイントがある中で抑えておくべき重要なポイントについて解説いたします。
1)セミナーテーマ及び開催日時
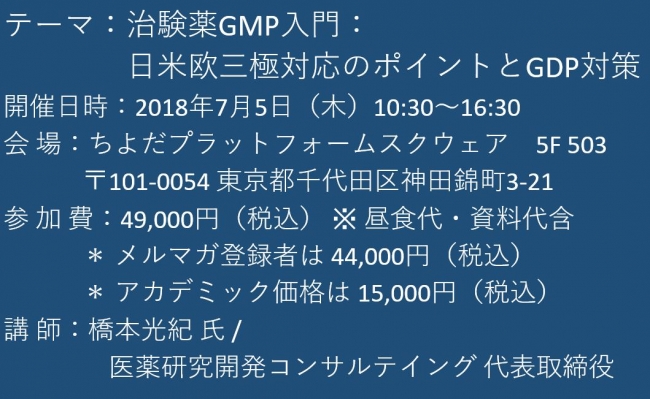
テーマ:治験薬GMP入門:日米欧三極対応のポイントとGDP対策
開催日時:2018年7月5日(木)10:30~16:30
会 場:ちよだプラットフォームスクウェア 5F 503
〒101-0054 東京都千代田区神田錦町3-21
参 加 費:49,000円(税込) ※ 昼食代・資料代含
* メルマガ登録者は 44,000円(税込)
* アカデミック価格は 15,000円(税込)
講 師:橋本光紀 氏 / 医薬研究開発コンサルテイング 代表取締役
2)申し込み方法
以下の↓シーエムシー・リサーチの当該セミナーサイトからお申し込みください。
http://cmcre.com/archives/33104/
折り返し、 聴講券、 会場地図、 請求書を送付いたします。
3)セミナープログラムの紹介
1. GMPとは
a) GMPの基本
b) GMPの歴史
c) GMPの三原則と記録
d) 経営者の責任と従業員の責任
e) 品質保証体制の確立
2.ICHとは
a) ICHにより何が変わったか
b) ICHQ9,Q10,Q11とCAPAについて
3.PIC/S GMPガイドラインについて
a) PIC/Sとは
b) PIC/Sの動きと日本の対応
c) サイトマスターファイルとは
d) PIC/S GMPガイドライン
e) PIC/SGMPガイドラインの位置づけ
4.新薬開発状況と欧米での承認状況
5.治験薬 GMP とは:なぜ治験薬GMPが必要なのか
a)治験薬の3原則
b) 治験薬GMPとGCPの位置づけ(日本、米港、EU)
c) Q7原薬GMPガイドラインにおける治験薬
d) 治験薬GMPと医薬品GMPの主な相違点と共通点
6.Annex13(治験薬製造)の要旨と留意点
a) Annex13とは
b) Annex13のポイント
c) Annex13の活用
7.治験薬製造の参考になる法やガイドライン
a) 国際標準として
b) 日本
c) アメリカ
d) 欧州
e) 三極におけるGMP用件の違い
8.治験薬GMPにおける治験薬製造、品質管理上の留意点
a) 目的
b) 考え方
c) 治験薬品質の一貫性と同等性
d) 開発段階での変更管理
e) 治験薬製造における留意点
f) 治験薬の品質管理における留意点
g) 治験薬GMPのポイウントと対応策
9.適格性評価とは:なぜ必要か、その進め方は
a) DQ(設計時適格性評価)
b) IQ(据付時適格性評価)
c) OQ(運転時適格性評価)
d) PQ(稼働時適格性評価)
10.治験薬に関する文書
11.手順書等に関する留意点とポイント
12.治験薬受託製造の留意点
13.治験薬の出荷承認手順
14.教育訓練の必要性と実施上の留意点
15.変更と逸脱管理
16.治験薬GMPに関するQ&A
17.生データ・実験ノートの留意点:データの信ぴょう性とデータインテグリティ
18.GDP(Good Distribution Practice)とは
a)GDPの必要性:なぜGDPが要求されるようになったか
b) GDPの概要と業務
c) 治験薬におけるGDP
d) GDPへの企業としての取り組み
e) 流通業者とのギャップと対応策
f) 偽造医薬品問題
19.開発フェーズ毎に沿ったバリデーションの考え方
20.製薬企業の最近の動向
21.まとめ
4)講師のご紹介
橋本光紀 氏 / 医薬研究開発コンサルテイング 代表取締役
【講師経歴】
1966年3月 九州大学薬学部修士課程修了
1966年4月 三共(株)生産技術研究所入社
1970年4月~1973年3月 東京工業大学向山光昭教授へ国内留学 理学博士号取得
1976年9月~1977年8月 M.I.T. Prof.Hecht 研へ海外留学
1977年9月~1978年8月 U.C.I .Prof.Overman 研へ海外留学
1989年8月 国際開発部勤務
1992年3月~1997年12月 Sankyo Pharma GmbH(ドイツ、ミュンヘン)研究開発担当責任者として勤務
2002年6月 三共化成工業(株)研究開発担当常務
2006年10月 医薬研究開発コンサルテイング設立
2010年12月 創薬パートナーズを8名で立上げ 現在に至る
【活動内容】
企業コンサルテーション、講演、執筆、日本プロセス化学会監事
【講師から】
治験薬の製造は製造法が確立される前に行うことが大半であり、マルチ設備を使用しスケールもグラムからkgとまちまちであるケースが多い。つい実験室の延長のつもりで実施し、記録をしているかもしれないが、これには重大な落とし穴がある。これらの間違いを無くし順調な治験薬提供をするためのポイントを説明する。
5)セミナー対象者や特典について
★ アカデミック価格:学校教育法にて規定された国、 地方公共団体、 および学校法人格を有する大学、 大学院の教員、 学生に限ります。
★ 2名以上同時申込で申込者全員メルマガ会員登録をしていただいた場合、 2人目以降はメルマガ価格の半額です。
●セミナー対象者
製薬関連企業の研究開発、製造、分析、品質管理、CMC、ジェネリック医薬品 委受託製造担当者、初心者にも分かりやすく説明
●セミナーで得られる知識
医薬品業界の動向、GMP 関連、ICH の動向、PIC/S の動向、治療薬GMPと医薬品GMP、品質保証体制、GQP、GDPとGXP,分析法バリデーション、プロセスバリデーション、新薬承認状況
☆詳細とお申し込みはこちらから↓
http://cmcre.com/archives/33104/
6)関連セミナーのご案内 《受付中!》
◎医薬品製造における洗浄バリデーションの効果的方法
開催日時:2018年6月14日(木)10:30~16:30
☆詳細とお申し込みはこちらから↓
http://cmcre.com/archives/32929/
●開催予定のセミナー一覧はこちらから!↓
http://cmcre.com/archives/category/seminar/seminar_cmc_f/
7)関連書籍のご案内 《新刊!》
◎創薬のための細胞利用技術の最新動向と市場
■ 発 刊:2018年5月18日
■ 定 価:本体(白黒) 90,000円 + 消費税
■ 体 裁:A4判 並製 311頁
■ 発 行:(株)シーエムシー・リサーチ
☆詳細とお申し込みはこちらから↓
http://cmcre.com/archives/33932/
●発行書籍の一覧はこちらから↓
http://cmcre.com/archives/category/cmc_all/
以上
しかし、医薬品としての品質は臨床段階からGMPの規制がかかっており、安易な取り扱いはデータの信頼性を損なうばかりでなく開発にブレーキを掛ける事態となることを忘れてはいけません。如何に効率よく治験薬を製造していくべきか、GDPを含めデータの信ぴょう性など多くのチェックポイントがある中で抑えておくべき重要なポイントについて解説いたします。
1)セミナーテーマ及び開催日時
テーマ:治験薬GMP入門:日米欧三極対応のポイントとGDP対策
開催日時:2018年7月5日(木)10:30~16:30
会 場:ちよだプラットフォームスクウェア 5F 503
〒101-0054 東京都千代田区神田錦町3-21
参 加 費:49,000円(税込) ※ 昼食代・資料代含
* メルマガ登録者は 44,000円(税込)
* アカデミック価格は 15,000円(税込)
講 師:橋本光紀 氏 / 医薬研究開発コンサルテイング 代表取締役
2)申し込み方法
以下の↓シーエムシー・リサーチの当該セミナーサイトからお申し込みください。
http://cmcre.com/archives/33104/
折り返し、 聴講券、 会場地図、 請求書を送付いたします。
3)セミナープログラムの紹介
1. GMPとは
a) GMPの基本
b) GMPの歴史
c) GMPの三原則と記録
d) 経営者の責任と従業員の責任
e) 品質保証体制の確立
2.ICHとは
a) ICHにより何が変わったか
b) ICHQ9,Q10,Q11とCAPAについて
3.PIC/S GMPガイドラインについて
a) PIC/Sとは
b) PIC/Sの動きと日本の対応
c) サイトマスターファイルとは
d) PIC/S GMPガイドライン
e) PIC/SGMPガイドラインの位置づけ
4.新薬開発状況と欧米での承認状況
5.治験薬 GMP とは:なぜ治験薬GMPが必要なのか
a)治験薬の3原則
b) 治験薬GMPとGCPの位置づけ(日本、米港、EU)
c) Q7原薬GMPガイドラインにおける治験薬
d) 治験薬GMPと医薬品GMPの主な相違点と共通点
6.Annex13(治験薬製造)の要旨と留意点
a) Annex13とは
b) Annex13のポイント
c) Annex13の活用
7.治験薬製造の参考になる法やガイドライン
a) 国際標準として
b) 日本
c) アメリカ
d) 欧州
e) 三極におけるGMP用件の違い
8.治験薬GMPにおける治験薬製造、品質管理上の留意点
a) 目的
b) 考え方
c) 治験薬品質の一貫性と同等性
d) 開発段階での変更管理
e) 治験薬製造における留意点
f) 治験薬の品質管理における留意点
g) 治験薬GMPのポイウントと対応策
9.適格性評価とは:なぜ必要か、その進め方は
a) DQ(設計時適格性評価)
b) IQ(据付時適格性評価)
c) OQ(運転時適格性評価)
d) PQ(稼働時適格性評価)
10.治験薬に関する文書
11.手順書等に関する留意点とポイント
12.治験薬受託製造の留意点
13.治験薬の出荷承認手順
14.教育訓練の必要性と実施上の留意点
15.変更と逸脱管理
16.治験薬GMPに関するQ&A
17.生データ・実験ノートの留意点:データの信ぴょう性とデータインテグリティ
18.GDP(Good Distribution Practice)とは
a)GDPの必要性:なぜGDPが要求されるようになったか
b) GDPの概要と業務
c) 治験薬におけるGDP
d) GDPへの企業としての取り組み
e) 流通業者とのギャップと対応策
f) 偽造医薬品問題
19.開発フェーズ毎に沿ったバリデーションの考え方
20.製薬企業の最近の動向
21.まとめ
4)講師のご紹介
橋本光紀 氏 / 医薬研究開発コンサルテイング 代表取締役
【講師経歴】
1966年3月 九州大学薬学部修士課程修了
1966年4月 三共(株)生産技術研究所入社
1970年4月~1973年3月 東京工業大学向山光昭教授へ国内留学 理学博士号取得
1976年9月~1977年8月 M.I.T. Prof.Hecht 研へ海外留学
1977年9月~1978年8月 U.C.I .Prof.Overman 研へ海外留学
1989年8月 国際開発部勤務
1992年3月~1997年12月 Sankyo Pharma GmbH(ドイツ、ミュンヘン)研究開発担当責任者として勤務
2002年6月 三共化成工業(株)研究開発担当常務
2006年10月 医薬研究開発コンサルテイング設立
2010年12月 創薬パートナーズを8名で立上げ 現在に至る
【活動内容】
企業コンサルテーション、講演、執筆、日本プロセス化学会監事
【講師から】
治験薬の製造は製造法が確立される前に行うことが大半であり、マルチ設備を使用しスケールもグラムからkgとまちまちであるケースが多い。つい実験室の延長のつもりで実施し、記録をしているかもしれないが、これには重大な落とし穴がある。これらの間違いを無くし順調な治験薬提供をするためのポイントを説明する。
5)セミナー対象者や特典について
★ アカデミック価格:学校教育法にて規定された国、 地方公共団体、 および学校法人格を有する大学、 大学院の教員、 学生に限ります。
★ 2名以上同時申込で申込者全員メルマガ会員登録をしていただいた場合、 2人目以降はメルマガ価格の半額です。
●セミナー対象者
製薬関連企業の研究開発、製造、分析、品質管理、CMC、ジェネリック医薬品 委受託製造担当者、初心者にも分かりやすく説明
●セミナーで得られる知識
医薬品業界の動向、GMP 関連、ICH の動向、PIC/S の動向、治療薬GMPと医薬品GMP、品質保証体制、GQP、GDPとGXP,分析法バリデーション、プロセスバリデーション、新薬承認状況
☆詳細とお申し込みはこちらから↓
http://cmcre.com/archives/33104/
6)関連セミナーのご案内 《受付中!》
◎医薬品製造における洗浄バリデーションの効果的方法
開催日時:2018年6月14日(木)10:30~16:30
☆詳細とお申し込みはこちらから↓
http://cmcre.com/archives/32929/
●開催予定のセミナー一覧はこちらから!↓
http://cmcre.com/archives/category/seminar/seminar_cmc_f/
7)関連書籍のご案内 《新刊!》
◎創薬のための細胞利用技術の最新動向と市場
■ 発 刊:2018年5月18日
■ 定 価:本体(白黒) 90,000円 + 消費税
■ 体 裁:A4判 並製 311頁
■ 発 行:(株)シーエムシー・リサーチ
☆詳細とお申し込みはこちらから↓
http://cmcre.com/archives/33932/
●発行書籍の一覧はこちらから↓
http://cmcre.com/archives/category/cmc_all/
以上
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
