非膜型細胞小器官p62顆粒の機能を解明
~ p62顆粒はオートファジーおよび抗酸化ストレス応答を制御する機能的液滴である ~
順天堂大学大学院医学研究科 器官・細胞生理学の小松雅明 教授、蔭山俊 助教らの研究グループは、肝臓がんや神経変性疾患病変部で確認されるたんぱく質p62(*1)顆粒の機能を解明しました。本研究により、機能のない凝集体と考えられてきたp62顆粒がオートファゴソーム(*2)形成や酸化ストレス応答を活性化する非膜型細胞小器官(液滴*3)であること、選択的オートファジー(*4)によるp62液滴分解の阻害が抗酸化ストレス応答を異常亢進(高い度合いに進行)させることを明らかにしました。この研究成果は、古くから知られる癌や神経変性疾患で確認されるp62構造体の病態生理学的意義を再考させるだけでなく、オートファジーによる選択的基質認識機構、そしてオートファジーの新たな生理機能を示しました。
本研究成果は科学雑誌Nature Communications に2021年1月4日付で発表されました。
本研究成果は科学雑誌Nature Communications に2021年1月4日付で発表されました。
本研究成果のポイント
背景
肝臓がんや神経変性疾患病変部の細胞で確認されるp62顆粒は不可逆的な機能が失われた凝集体あるいは封入体と考えらてきました。しかし、最近、p62顆粒は、その内部に流動性と生化学反応が維持されている可逆的な構造体、すなわち非膜型細胞小器官(液滴)の一種であることがわかってきました。一般に、液滴形成は環境の変化といった細胞外の影響によるストレス応答反応と考えられますが、p62顆粒の生理作用は不明でした。さらに、p62顆粒はオートファジーにより選択的に分解されることが示されてきましたが、その選択性を担う分子機構も未解明でした。そこで本研究ではp62顆粒の機能を明らかにする目的で行いました。
内容
今回、研究グループは、選択的オートファジーを阻害する人工プローブ(*5)などによりp62顆粒の形成を誘導し、p62顆粒上の様々なタンパク質や膜動態を電子顕微鏡などで観察しました。その結果、p62顆粒には多数のオートファジー関連たんぱく質が集積、p62顆粒上で多数のオートファゴソームが形成されること(図1)、p62とオートファゴソーム局在たんぱく質ATG8ファミリーたんぱく質との結合によりp62顆粒がオートファゴソームに取り囲まれ、選択的オートファジーにより分解されることを明らかにしました。
今後の展開
オートファジーの研究分野は今なお成長を続けており、これは大隅良典博士がノーベル賞を単独受賞したことからも首肯できます。オートファジー領域の研究はこれまでオートファジーの分子機構あるいは基本的な生理機能の研究により発展してきましたが、依然と未解明の重要課題が残されています。オートファジーによる選択的基質分解に関しては個々の基質に関してメカニズムの一端が国内外の研究者により提供されているものの全容解明には程遠い状況です。
オートファジーは液滴あるいはゲル化したたんぱく質群の選択的分解により、様々な細胞の高次機能を制御し、個体の恒常性維持に貢献すると考えられます。しかし、どのような分子が相分離しオートファジーの選択的基質となるのか、それら選択基質の相分離の制御機構、相分離基質に沿ったオートファゴソーム形成機構、そしてそれらの分解の生理的意義はほとんど手つかずの状態であり、これらを解明することが求められています。今回の結果はオートファジーによる選択的な液滴分解の生理機能をマウス個体で示した初めての成果であり、オートファジーや液滴の異常が関与する様々な疾患の発症メカニズムの解明につながる可能性があります。
用語解説
1. p62(タンパク質)
肝細胞癌や神経変性疾患の病変細胞では巨大な構造体であるp62顆粒を形成する。 p62は、たんぱく質恒常性の破綻、酸化ストレス、あるいは炎症性ストレスなどにより発現誘導される多機能たんぱく質である。最も代表的なオートファジー選択的分解基質であり、ユビキチン化たんぱく質と結合することで液−液相分離を起こす。 オートファジー関連たんぱく質であるFIP200やATG8ファミリーたんぱく質や転写因子Nrf2を負に制御するKeap1とも結合することが知られている。
2. オートファゴソーム
オートファゴソームは細胞成分の一部を取り囲んだ脂質二重膜構造体であり、リソソームと融合することで細胞成分は分解される。小胞体、ミトコンドリア、ゴルジ体、細胞膜、さらにはリサイクリングエンドソーム由来の多彩な膜成分がオートファゴソーム膜形成に寄与すると考えられており、その形成から内容物の分解までオートファジー関連遺伝子産物ATGたんぱく質群により厳密に制御されている。
3. 液滴
液−液相分離により濃縮されたたんぱく質やRNA分子の液相は、エネルギー的に安定するべく融合し球形を取る。このような構造体は、液体様の性質を備えていることから液滴(liquid droplet)と呼ばれ、その内部は流動性と生化学反応が維持されている可逆的な構造体である。細胞内にはストレス顆粒、生殖顆粒や核小体など多数の液滴が存在しており、環境の変化といった外乱の影響によって変化することを阻止する働きをする。
4. 選択的オートファジー
オートファジーは、無作為に細胞成分を分解すると考えられてきた。しかし、ある状況下では特定の積み荷をオートファゴソームが選択的に認識、隔離、分解する。このオートファジーは選択的オートファジーと呼ばれ、特定の可溶性タンパク質、タンパク質凝集体、不要なオルガネラ、病原性細菌を分解することで細胞の恒常性維持に貢献している 。
5. 人工プローブ
オートファゴソーム内膜のATG8ファミリーたんぱく質に特異的に結合する人工的に作られたたんぱく質。オートファゴソーム形成には影響を与えないが、オートファゴソームの内膜のATG8ファミリーたんぱく質と基質群との相互作用を競合的に阻害することで選択的オートファジーのみを阻害する。
6. Keap1、Nrf2
Keap1-Nrf2経路:Nrf2は抗酸化ストレス応答を制御する主要な転写因子である。正常状態では、Nrf2はユビキチンリガーゼのアダプターたんぱく質であるKeap1に認識され、ユビキチン化を受け、プロテアソームにより恒常的に分解されている。たんぱく質恒常性の破綻、酸化ストレス、あるいは炎症性ストレスなどによりp62たんぱく質が発現誘導されると、p62の349番目のセリン残基のリン酸化依存的にKeap1がp62と結合する。その結果、Nrf2は安定化、核移行し、様々な抗ストレス性遺伝子発現を誘導する。
原著論文
本研究は、Nature Publishing Groupの「Nature Communications」(https://www.nature.com/ncomms/)オンライン版に2021年1月4日付で公開されました。
英文タイトル: p62/SQSTM1-droplet serves as a platform for autophagosome formation and anti-oxidative stress response
日本語訳: p62顆粒は酸化ストレス応答を制御しオートファゴソーム形成の足場としても働く機能的液滴である
著者: Shun Kageyama1,#, Sigurdur Runar Gudmundsson2,#, Yu-Shin Sou3, Yoshinobu Ichimura1, Naoki Tamura4, Saiko Kazuno5, Takashi Ueno5, Yoshiki Miura5, Daisuke Noshiro6, Manabu Abe7, Tsunehiro Mizushima8, Nobuaki Miura9, Shujiro Okuda9, Hozumi Motohashi10, Jin-A Lee11, Kenji Sakimura7, Tomoyuki Ohe12, Nobuo N. Noda6, Satoshi Waguri4, Eeva-Liisa Eskelinen2,13,*, Masaaki Komatsu1,*
著者(日本語表記):蔭山 俊1,#、Sigurdur Gudmundsson2,#、曽 友深3、一村義信1、田村直輝4、數野彩子5、上野 隆5、三浦芳樹5、能代大輔6、阿部 学7、水島恒裕8、三浦信明9、奥田修二郎9、本橋ほづみ10、 Jin-A Lee11 、﨑村建司7、大江知之12、野田展生6、和栗 聡4、Eeva-Liisa Eskelinen2,13,*、小松雅明1,*
所属 1順天堂大学大学院医学研究科器官・細胞生理学講座、2Molecular and Integrative Biosciences Research Program, University of Helsinki、3順天堂大学大学院医学研究科神経機能構造学講座、4福島県立医科大学解剖・組織学講座、5順天堂大学大学院医学研究科研究基盤センター、6微生物化学研究所第3生物活性研究部、7新潟大学脳研究所モデル動物開発分野、8兵庫県立大学理学部構造細胞生理学分野、 9新潟大学大学院医歯学総合研究科バイオインフォマーティックス分野、 10東北大学加齢医学研究所加齢制御研究部門、11Department of Biological Sciences and Biotechnology, College of Life Sciences and Nanotechnology, Hannam University、 12慶應義塾大学薬学部医薬品化学、13Institute of Biomedicine, University of Turku
DOI: 10.1038/s41467-020-20185-1
本研究は、科学研究費助成基金助成金JSPS科研費(基盤研究(C)JP 20K06549)、新学術領域研究JP 19H05706、基盤研究JP 18H02611 )、日本学術振興会A3フォーサイト事業、武田科学振興財団などの支援を受け実施されました。
- p62顆粒はオートファゴソーム形成の足場として機能し、オートファゴソーム局在たんぱく質との結合により選択的オートファジーで分解される。
- p62顆粒は酸化ストレス応答を制御する機能的液滴であり、p62顆粒の分解阻害は抗酸化ストレス応答を異常亢進させることを明らかにした。
- p62顆粒によるオートファジーの新たな生理機能を示したことにより、オートファジーや液滴の異常が関与する様々な疾患の発症メカニズムの解明につながる可能性がある。
背景
肝臓がんや神経変性疾患病変部の細胞で確認されるp62顆粒は不可逆的な機能が失われた凝集体あるいは封入体と考えらてきました。しかし、最近、p62顆粒は、その内部に流動性と生化学反応が維持されている可逆的な構造体、すなわち非膜型細胞小器官(液滴)の一種であることがわかってきました。一般に、液滴形成は環境の変化といった細胞外の影響によるストレス応答反応と考えられますが、p62顆粒の生理作用は不明でした。さらに、p62顆粒はオートファジーにより選択的に分解されることが示されてきましたが、その選択性を担う分子機構も未解明でした。そこで本研究ではp62顆粒の機能を明らかにする目的で行いました。
内容
今回、研究グループは、選択的オートファジーを阻害する人工プローブ(*5)などによりp62顆粒の形成を誘導し、p62顆粒上の様々なタンパク質や膜動態を電子顕微鏡などで観察しました。その結果、p62顆粒には多数のオートファジー関連たんぱく質が集積、p62顆粒上で多数のオートファゴソームが形成されること(図1)、p62とオートファゴソーム局在たんぱく質ATG8ファミリーたんぱく質との結合によりp62顆粒がオートファゴソームに取り囲まれ、選択的オートファジーにより分解されることを明らかにしました。
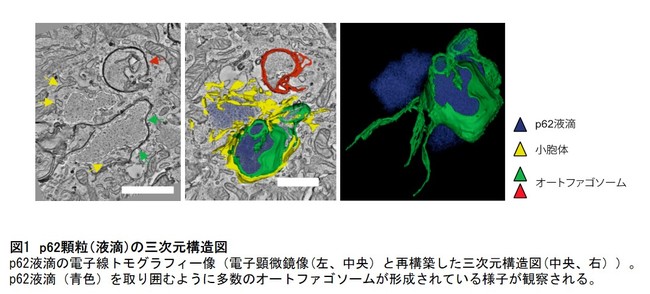 図1 p62顆粒(液滴)の三次元構造図
図1 p62顆粒(液滴)の三次元構造図
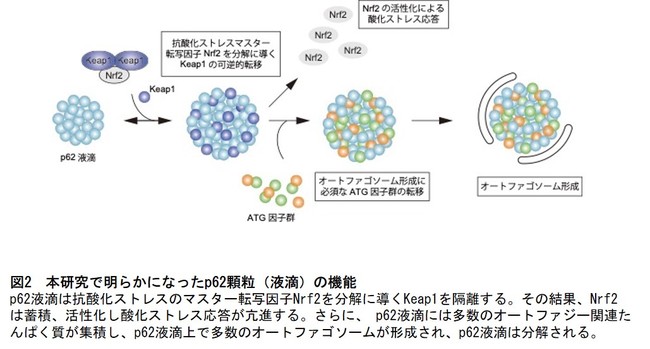 図2 本研究で明らかになったp62顆粒(液滴)の機能
図2 本研究で明らかになったp62顆粒(液滴)の機能
今後の展開
オートファジーの研究分野は今なお成長を続けており、これは大隅良典博士がノーベル賞を単独受賞したことからも首肯できます。オートファジー領域の研究はこれまでオートファジーの分子機構あるいは基本的な生理機能の研究により発展してきましたが、依然と未解明の重要課題が残されています。オートファジーによる選択的基質分解に関しては個々の基質に関してメカニズムの一端が国内外の研究者により提供されているものの全容解明には程遠い状況です。
オートファジーは液滴あるいはゲル化したたんぱく質群の選択的分解により、様々な細胞の高次機能を制御し、個体の恒常性維持に貢献すると考えられます。しかし、どのような分子が相分離しオートファジーの選択的基質となるのか、それら選択基質の相分離の制御機構、相分離基質に沿ったオートファゴソーム形成機構、そしてそれらの分解の生理的意義はほとんど手つかずの状態であり、これらを解明することが求められています。今回の結果はオートファジーによる選択的な液滴分解の生理機能をマウス個体で示した初めての成果であり、オートファジーや液滴の異常が関与する様々な疾患の発症メカニズムの解明につながる可能性があります。
用語解説
1. p62(タンパク質)
肝細胞癌や神経変性疾患の病変細胞では巨大な構造体であるp62顆粒を形成する。 p62は、たんぱく質恒常性の破綻、酸化ストレス、あるいは炎症性ストレスなどにより発現誘導される多機能たんぱく質である。最も代表的なオートファジー選択的分解基質であり、ユビキチン化たんぱく質と結合することで液−液相分離を起こす。 オートファジー関連たんぱく質であるFIP200やATG8ファミリーたんぱく質や転写因子Nrf2を負に制御するKeap1とも結合することが知られている。
2. オートファゴソーム
オートファゴソームは細胞成分の一部を取り囲んだ脂質二重膜構造体であり、リソソームと融合することで細胞成分は分解される。小胞体、ミトコンドリア、ゴルジ体、細胞膜、さらにはリサイクリングエンドソーム由来の多彩な膜成分がオートファゴソーム膜形成に寄与すると考えられており、その形成から内容物の分解までオートファジー関連遺伝子産物ATGたんぱく質群により厳密に制御されている。
3. 液滴
液−液相分離により濃縮されたたんぱく質やRNA分子の液相は、エネルギー的に安定するべく融合し球形を取る。このような構造体は、液体様の性質を備えていることから液滴(liquid droplet)と呼ばれ、その内部は流動性と生化学反応が維持されている可逆的な構造体である。細胞内にはストレス顆粒、生殖顆粒や核小体など多数の液滴が存在しており、環境の変化といった外乱の影響によって変化することを阻止する働きをする。
4. 選択的オートファジー
オートファジーは、無作為に細胞成分を分解すると考えられてきた。しかし、ある状況下では特定の積み荷をオートファゴソームが選択的に認識、隔離、分解する。このオートファジーは選択的オートファジーと呼ばれ、特定の可溶性タンパク質、タンパク質凝集体、不要なオルガネラ、病原性細菌を分解することで細胞の恒常性維持に貢献している 。
5. 人工プローブ
オートファゴソーム内膜のATG8ファミリーたんぱく質に特異的に結合する人工的に作られたたんぱく質。オートファゴソーム形成には影響を与えないが、オートファゴソームの内膜のATG8ファミリーたんぱく質と基質群との相互作用を競合的に阻害することで選択的オートファジーのみを阻害する。
6. Keap1、Nrf2
Keap1-Nrf2経路:Nrf2は抗酸化ストレス応答を制御する主要な転写因子である。正常状態では、Nrf2はユビキチンリガーゼのアダプターたんぱく質であるKeap1に認識され、ユビキチン化を受け、プロテアソームにより恒常的に分解されている。たんぱく質恒常性の破綻、酸化ストレス、あるいは炎症性ストレスなどによりp62たんぱく質が発現誘導されると、p62の349番目のセリン残基のリン酸化依存的にKeap1がp62と結合する。その結果、Nrf2は安定化、核移行し、様々な抗ストレス性遺伝子発現を誘導する。
原著論文
本研究は、Nature Publishing Groupの「Nature Communications」(https://www.nature.com/ncomms/)オンライン版に2021年1月4日付で公開されました。
英文タイトル: p62/SQSTM1-droplet serves as a platform for autophagosome formation and anti-oxidative stress response
日本語訳: p62顆粒は酸化ストレス応答を制御しオートファゴソーム形成の足場としても働く機能的液滴である
著者: Shun Kageyama1,#, Sigurdur Runar Gudmundsson2,#, Yu-Shin Sou3, Yoshinobu Ichimura1, Naoki Tamura4, Saiko Kazuno5, Takashi Ueno5, Yoshiki Miura5, Daisuke Noshiro6, Manabu Abe7, Tsunehiro Mizushima8, Nobuaki Miura9, Shujiro Okuda9, Hozumi Motohashi10, Jin-A Lee11, Kenji Sakimura7, Tomoyuki Ohe12, Nobuo N. Noda6, Satoshi Waguri4, Eeva-Liisa Eskelinen2,13,*, Masaaki Komatsu1,*
著者(日本語表記):蔭山 俊1,#、Sigurdur Gudmundsson2,#、曽 友深3、一村義信1、田村直輝4、數野彩子5、上野 隆5、三浦芳樹5、能代大輔6、阿部 学7、水島恒裕8、三浦信明9、奥田修二郎9、本橋ほづみ10、 Jin-A Lee11 、﨑村建司7、大江知之12、野田展生6、和栗 聡4、Eeva-Liisa Eskelinen2,13,*、小松雅明1,*
所属 1順天堂大学大学院医学研究科器官・細胞生理学講座、2Molecular and Integrative Biosciences Research Program, University of Helsinki、3順天堂大学大学院医学研究科神経機能構造学講座、4福島県立医科大学解剖・組織学講座、5順天堂大学大学院医学研究科研究基盤センター、6微生物化学研究所第3生物活性研究部、7新潟大学脳研究所モデル動物開発分野、8兵庫県立大学理学部構造細胞生理学分野、 9新潟大学大学院医歯学総合研究科バイオインフォマーティックス分野、 10東北大学加齢医学研究所加齢制御研究部門、11Department of Biological Sciences and Biotechnology, College of Life Sciences and Nanotechnology, Hannam University、 12慶應義塾大学薬学部医薬品化学、13Institute of Biomedicine, University of Turku
DOI: 10.1038/s41467-020-20185-1
本研究は、科学研究費助成基金助成金JSPS科研費(基盤研究(C)JP 20K06549)、新学術領域研究JP 19H05706、基盤研究JP 18H02611 )、日本学術振興会A3フォーサイト事業、武田科学振興財団などの支援を受け実施されました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
