悪性高熱症および重度熱中症に対する新規治療薬候補を創出
~ より安全な悪性高熱症治療へ向けて ~
順天堂大学大学院医学研究科 細胞・分子薬理学の小林 琢也 特任研究員、呉林 なごみ 客員准教授、村山 尚 准教授と東京慈恵会医科大学・分子生理学講座の山澤 德志子 准教授らは、国立精神・神経医療研究センター、東京医科歯科大学、Mount Sinai Medical Center、University of Leeds、京都大学、大阪大学と共同で、1型リアノジン受容体(RyR1)*1選択的阻害物質であるCpd1(*2)が、悪性高熱症および重度の熱中症に対して優れた治療効果を持つことを明らかにしました。本研究では、Cpd1が悪性高熱症のモデルマウスにおいて発症予防および治療効果を持つこと、既存薬に比べて水溶性が高く、血中半減期(*3)が短いことを確認しました。本成果は、Cpd1がより安全な悪性高熱症治療薬の有望な候補であることを示しています。本研究成果は、英国科学雑誌「Nature Communications」のオンライン版(日本時間2021年 7月13日)で公開されました。
本研究成果のポイント
背景
悪性高熱症は外科手術時の吸入麻酔により筋の持続収縮(筋硬直)が起こり高熱を発する重篤な疾患です。悪性高熱症の主な原因は筋小胞体(*4)のカルシウムイオン*5(Ca2+)チャネルである1型リアノジン受容体(RyR1)の遺伝子突然変異による異常活性化であり、吸入麻酔薬によりCa2+遊離が起こり筋が収縮することで発熱します。治療薬としては筋弛緩薬の一つであるRyR1阻害薬のダントロレンが使用されていますが、点滴静脈注射用の生理食塩水に溶けないことや、血中半減期が長く副作用のリスクが高いという欠点がありました。そのため、これらを改善した新しい治療薬が求められてきました。そこで研究グループは化合物ライブラリからの候補物質の選抜と構造展開(*6)により、ダントロレンとは構造が異なる新たなRyR1阻害薬の開発を進めてきました。本研究では、新たに治療薬の候補として見出したRyR1阻害物質Cpd1の悪性高熱症に対する治療効果を明らかにすることを目的として、タイプの異なる悪性高熱症モデルマウスを用いて調べました。
内容
今回、研究グループはCpd1の治療効果を調べるため、新たに悪性高熱症モデルマウス(RYR1-p.R2509C)を作出しました。このマウスはRyR1チャネル活性が高く、イソフルラン麻酔により悪性高熱発作を起こし体温が急上昇して死亡します。このモデルマウスに麻酔をかけた後にCpd1を投与したところ、発熱が抑えられ、死亡を防ぎました(図1A, B)。
今後の展開
悪性高熱症は吸入麻酔により急激に発症するため、迅速な対応が必要です。一方で、症状の回復後は速やかな薬物の消失が求められます。Cpd1はダントロレンに比較して高い水溶性と短い血中半減期を有することから、より安全に使用できる悪性高熱症の治療薬になる可能性を有しています。研究グループはCpd1のさらなる構造展開による治療薬開発を進めています。重篤な症状を示す熱中症の患者さんの中にはRYR1遺伝子の突然変異が報告されています。また、RyR1の異常活性化は筋ジストロフィーをはじめとした筋疾患でも報告されています。そのため、Cpd1は重度熱中症や種々の筋疾患に対する治療薬になる可能性もあり、今後の研究が進めば、将来的に臨床応用されることが期待されます。
用語解説
*1 1型リアノジン受容体(RyR1):骨格筋筋小胞体のCa2+チャネル。収縮に必要なCa2+を遊離する。
*2 Cpd1:キノロン系抗菌薬オキソリン酸を構造展開して見出された化合物。ダントロレンに比べてin vitroでのRyR1に対する親和性が5倍上昇し、水溶性が30倍向上している。
*3 血中半減期:血中の薬物濃度が半分になる時間。長いと薬物が体内に蓄積しやすい。
*4 筋小胞体:筋細胞の小胞体。筋収縮時に必要な細胞内Ca2+を貯蔵する役割を持つ。
*5 カルシウムイオン:細胞内セカンドメッセンジャー。筋細胞では筋収縮を起こす引き金になる。
*6 構造展開:薬理作用のある化合物の構造を少しずつ変えて、より良い化合物を見つけること。
原著論文
本研究はNature Communications誌のオンライン版で(2020年7月13日付)公開されました。
タイトル: A novel RyR1-selective inhibitor prevents and rescues sudden death in mouse models of malignant hyperthermia and heat stroke.
タイトル(日本語訳): 新規RyR1選択的阻害物質は悪性高熱症・熱中症モデルマウスの突然死を予防・治療する
著者:Toshiko Yamazawa1)*#, Takuya Kobayashi2)*, Nagomi Kurebayashi2)*, Masato Konishi2), Satoru Noguchi3), Takayoshi Inoue3), Yukiko U. Inoue3), Ichizo Nishino3), Shuichi Mori4), Hiroto Iinuma4), Noriaki Manaka4), Hiroyuki Kagechika4), Arkady Uryash5), Jose Adams5), Jose R. Lopez5), Xiaochen Liu6), Christine Diggle6), Paul D. Allen6), Sho Kakizawa7), Keigo Ikeda8), Bangzhong Lin8), Yui Ikemi8), Kazuto Nunomura8), Shinsaku Nakagawa8), Takashi Sakurai2), Takashi Murayama2)# (*co-first author; #co-correspondence)
著者(日本語表記): 山澤 徳志子1)*#、小林 琢也2)*、呉林 なごみ2)*、小西 真人2)、野口 悟3)、井上 高良3) 、井上 由紀子3) 、西野 一三3) 、森 修一4)、飯沼 大翔4) 、間中 紀暁4) 、影近 弘之4) 、 Arkady Uryash5), Jose Adams5), Jose R. Lopez5), Xiaochen Liu6), Christine Diggle6), Paul D. Allen6)、柿澤 昌7)、池田 圭吾8)、 Bangzhong Lin 8) 、池見 唯8) 、布村 一人8) 、中川 晋作8) 、櫻井 隆2)、村山 尚2)#(*共同第一著者; #共同責任著者)
著者所属:1) 東京慈恵会医科大学、2) 順天堂大学、3) 国立精神・神経医療センター、4) 東京医科歯科大学、5) Mount Sinai Medical Center、6) University of Leeds、7) 京都大学、8) 大阪大学
DOI: 10.1038/s41467-021-24644-1
本研究はAMED創薬等ライフサイエンス研究支援基盤事業(JP20am0101098, JP20am0101085, JP20am0101123, JP20am0101080)、JSPS科研費(JP19K07306, JP19H03198, JP20H04511, JP20K11368, JP19K07105, JP19K06955, JP19H03404)および車両競技公益資金記念財団をはじめとした多くの支援を受け多施設との共同研究により実施されました。本研究にご協力いただいた皆様に深謝いたします。
- Cpd1は悪性高熱症モデルマウスに対して優れた治療効果を示した
- Cpd1は既存薬に比べて水溶性が高く、血中半減期が短い
- より安全な悪性高熱症・重度熱中症治療薬の開発へ
背景
悪性高熱症は外科手術時の吸入麻酔により筋の持続収縮(筋硬直)が起こり高熱を発する重篤な疾患です。悪性高熱症の主な原因は筋小胞体(*4)のカルシウムイオン*5(Ca2+)チャネルである1型リアノジン受容体(RyR1)の遺伝子突然変異による異常活性化であり、吸入麻酔薬によりCa2+遊離が起こり筋が収縮することで発熱します。治療薬としては筋弛緩薬の一つであるRyR1阻害薬のダントロレンが使用されていますが、点滴静脈注射用の生理食塩水に溶けないことや、血中半減期が長く副作用のリスクが高いという欠点がありました。そのため、これらを改善した新しい治療薬が求められてきました。そこで研究グループは化合物ライブラリからの候補物質の選抜と構造展開(*6)により、ダントロレンとは構造が異なる新たなRyR1阻害薬の開発を進めてきました。本研究では、新たに治療薬の候補として見出したRyR1阻害物質Cpd1の悪性高熱症に対する治療効果を明らかにすることを目的として、タイプの異なる悪性高熱症モデルマウスを用いて調べました。
内容
今回、研究グループはCpd1の治療効果を調べるため、新たに悪性高熱症モデルマウス(RYR1-p.R2509C)を作出しました。このマウスはRyR1チャネル活性が高く、イソフルラン麻酔により悪性高熱発作を起こし体温が急上昇して死亡します。このモデルマウスに麻酔をかけた後にCpd1を投与したところ、発熱が抑えられ、死亡を防ぎました(図1A, B)。
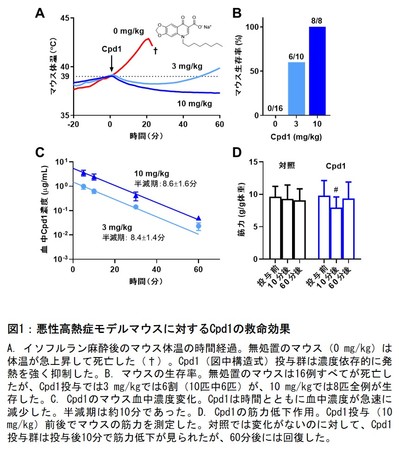 図1:悪性高熱症モデルマウスに対するCpd1の救命効果
図1:悪性高熱症モデルマウスに対するCpd1の救命効果
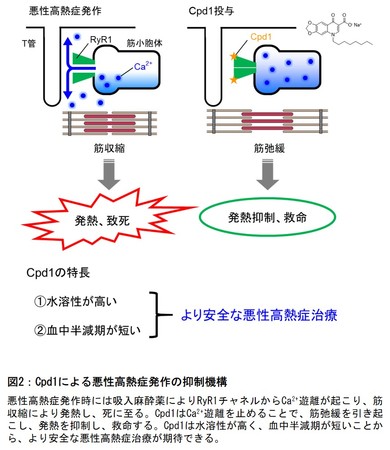 図2:Cpd1による悪性高熱症発作の抑制機構
図2:Cpd1による悪性高熱症発作の抑制機構
今後の展開
悪性高熱症は吸入麻酔により急激に発症するため、迅速な対応が必要です。一方で、症状の回復後は速やかな薬物の消失が求められます。Cpd1はダントロレンに比較して高い水溶性と短い血中半減期を有することから、より安全に使用できる悪性高熱症の治療薬になる可能性を有しています。研究グループはCpd1のさらなる構造展開による治療薬開発を進めています。重篤な症状を示す熱中症の患者さんの中にはRYR1遺伝子の突然変異が報告されています。また、RyR1の異常活性化は筋ジストロフィーをはじめとした筋疾患でも報告されています。そのため、Cpd1は重度熱中症や種々の筋疾患に対する治療薬になる可能性もあり、今後の研究が進めば、将来的に臨床応用されることが期待されます。
用語解説
*1 1型リアノジン受容体(RyR1):骨格筋筋小胞体のCa2+チャネル。収縮に必要なCa2+を遊離する。
*2 Cpd1:キノロン系抗菌薬オキソリン酸を構造展開して見出された化合物。ダントロレンに比べてin vitroでのRyR1に対する親和性が5倍上昇し、水溶性が30倍向上している。
*3 血中半減期:血中の薬物濃度が半分になる時間。長いと薬物が体内に蓄積しやすい。
*4 筋小胞体:筋細胞の小胞体。筋収縮時に必要な細胞内Ca2+を貯蔵する役割を持つ。
*5 カルシウムイオン:細胞内セカンドメッセンジャー。筋細胞では筋収縮を起こす引き金になる。
*6 構造展開:薬理作用のある化合物の構造を少しずつ変えて、より良い化合物を見つけること。
原著論文
本研究はNature Communications誌のオンライン版で(2020年7月13日付)公開されました。
タイトル: A novel RyR1-selective inhibitor prevents and rescues sudden death in mouse models of malignant hyperthermia and heat stroke.
タイトル(日本語訳): 新規RyR1選択的阻害物質は悪性高熱症・熱中症モデルマウスの突然死を予防・治療する
著者:Toshiko Yamazawa1)*#, Takuya Kobayashi2)*, Nagomi Kurebayashi2)*, Masato Konishi2), Satoru Noguchi3), Takayoshi Inoue3), Yukiko U. Inoue3), Ichizo Nishino3), Shuichi Mori4), Hiroto Iinuma4), Noriaki Manaka4), Hiroyuki Kagechika4), Arkady Uryash5), Jose Adams5), Jose R. Lopez5), Xiaochen Liu6), Christine Diggle6), Paul D. Allen6), Sho Kakizawa7), Keigo Ikeda8), Bangzhong Lin8), Yui Ikemi8), Kazuto Nunomura8), Shinsaku Nakagawa8), Takashi Sakurai2), Takashi Murayama2)# (*co-first author; #co-correspondence)
著者(日本語表記): 山澤 徳志子1)*#、小林 琢也2)*、呉林 なごみ2)*、小西 真人2)、野口 悟3)、井上 高良3) 、井上 由紀子3) 、西野 一三3) 、森 修一4)、飯沼 大翔4) 、間中 紀暁4) 、影近 弘之4) 、 Arkady Uryash5), Jose Adams5), Jose R. Lopez5), Xiaochen Liu6), Christine Diggle6), Paul D. Allen6)、柿澤 昌7)、池田 圭吾8)、 Bangzhong Lin 8) 、池見 唯8) 、布村 一人8) 、中川 晋作8) 、櫻井 隆2)、村山 尚2)#(*共同第一著者; #共同責任著者)
著者所属:1) 東京慈恵会医科大学、2) 順天堂大学、3) 国立精神・神経医療センター、4) 東京医科歯科大学、5) Mount Sinai Medical Center、6) University of Leeds、7) 京都大学、8) 大阪大学
DOI: 10.1038/s41467-021-24644-1
本研究はAMED創薬等ライフサイエンス研究支援基盤事業(JP20am0101098, JP20am0101085, JP20am0101123, JP20am0101080)、JSPS科研費(JP19K07306, JP19H03198, JP20H04511, JP20K11368, JP19K07105, JP19K06955, JP19H03404)および車両競技公益資金記念財団をはじめとした多くの支援を受け多施設との共同研究により実施されました。本研究にご協力いただいた皆様に深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
