製薬企業のMR向け、スマートデバイスを利用した副作用報告支援システム「PVLink Camera Report」を販売開始

国内の製薬企業は、医薬品の副作用によるものと疑われる症例等を確認した場合、PMDA(独立行政法人 医薬品医療機器総合機構)に対しその副作用情報を報告することが義務づけられています。一般的に副作用情報は、製薬企業のMR(医薬情報担当者)が医療機関等を訪問し収集しています。そしてその情報は自社にある医薬品の安全管理部門に報告され、情報の評価や再調査を実施し副作用報告が必要なものをPMDAに送付しています。
MRが自社の安全管理部門へ行う副作用情報報告には、迅速さ、正確さ、情報送信の安全性が求められるという課題があります。しかしながら、現状では多くの製薬企業においてはFAXやEメールを使用した報告が行われており、宛先間違いや、誤ったデータを配信してしまうなどの人為ミスを防止する仕組みが無く、都度手作業で送信する必要があることも、運用上の課題のひとつとなっています。キヤノンITSはこのような課題を解決するために、スマートデバイスを使用した副作用報告支援システム「PVLink Camera Report」を開発しました。「PVLink Camera Report」は、報告書を最適化して送信する報告用アプリと、その報告を安全に受領して自動的に受領連絡を行うサーバソフトウェアで構成されています。MRは報告用アプリを利用することで、煩雑な業務を軽減できるとともに、自社の安全管理部門においては迅速かつセキュアな報告が実現できます。また、情報連携が容易になるため、報告遅延や報告漏れを防ぐことも可能になり、PMDAへの副作用報告を円滑に行うことができます。
■「PVLink Camera Report」概要図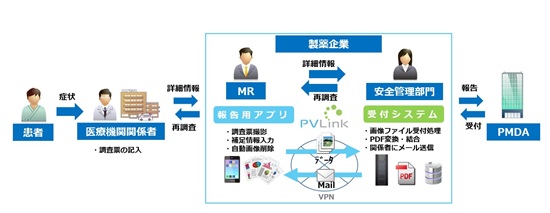
キヤノンITSは、EDIシステム「EDI-Master DEX for Medical」(※)を製薬企業向けソリューションとして提供しており、これまでPMDAに対する副作用報告の情報配信の仕組みとして、大手製薬企業の大多数である80社以上の導入実績があります。今後もキヤノンITSは副作用報告についてトータルなソリューションを展開し、「EDI-Master」を中核とするEDIソリューション関連事業で、2020年に年間売上高25億円を目指します。
※キヤノンITSの個別症例安全性報告を電子的に伝送する製薬企業に特化したEDIシステム

| 製品名 | 価格(税別) | 発売日 |
| PVLink Camera Report Ver.1.0 ベースライセンス |
300万円 | 2017年6月上旬 |
| PVLink Camera Report Ver.1.0 MR ライセンス(MR100名) |
50万円 | 2017年6月上旬 |
※ベースライセンスには、100名分のMRライセンスが含まれます。
※100名以上でご利用の場合は、PVLink Camera Report MRライセンスの追加が必要です。
■「PVLink Camera Report」の概要
【報告用アプリ(iPhone、iPad)】
MRが所有するスマートデバイスから、第一報連絡票および詳細調査票を撮影、報告、後処理を行うアプリケーション。調査対象をスマートデバイスのカメラで撮影、自動編集し、補足情報として医薬品名や情報源などを選択して報告が可能。完了後は自動で画像の削除が行われ、スマートデバイス上にはデータが残りません。
【受付システム】
報告用アプリから受領した複数の画像ファイルを結合、PDF変換し、指定のフォルダに出力します。受領完了メールをMRに、安全管理部門の関係者には、受付連絡メールがそれぞれ自動配信されます。
■「PVLink Camera Report」の特徴
【報告用アプリ】
・原稿撮影時に自動的にファイルサイズを縮小し、アップロード時の通信負荷を軽減
・カラー撮影、台形補正/グレースケール/コントラスト調整の自動実行
・A3モードで撮影時、A4画像2枚に自動で画像分割
【受付システム】
・メール通知設定(MRへの受領連絡、安全管理部門への受付連絡)
※PMDA(Pharmaceuticals and Medical Devices Agency:独立行政法人医薬品医療機器総合機構)
2004年4月設立。医薬品・医療機器・再生医療等製品の承認審査・安全対策・健康被害救済の3つの業務を行う組織。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像