細胞外異常タンパク質の除去システムを発見 アルツハイマー病治療薬になる可能性も
千葉大学大学院理学研究院 板倉英祐 助教らのグループは、血液中など細胞外に生じた異常タンパク質を細胞が自ら取り込み分解・除去する仕組みを発見しました。細胞の中の異常タンパク質分解の機能はオートファジーと呼ばれ、近年研究が進んでいますが、細胞の外の異常タンパク質に対しても細胞が働きかけられることが今回初めて実証されました。異常タンパク質の中には、アルツハイマー病の発症を引き起こすアミロイドβが含まれており、この仕組みによってアミロイドβの分解も促進されることから、アルツハイマー病治療への将来的な貢献が期待されます。本研究成果は、2020年2月18日に細胞生物学の専門誌「Journal of cell biology」で発表されました。
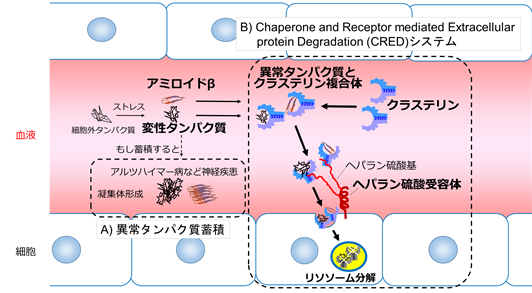
A)異常なタンパク質の蓄積はタンパク質凝集体形成を促進し様々な疾患の原因となる(図左下)。
B)クラステリンと結合した異常タンパク質は、ヘパラン硫酸基を持つヘパラン硫酸受容体によって捕らえられ、細胞内で分解される。この血液内の異常タンパク質を分解する一連のシステムを発見し、Chaperone and Receptor mediated Extracellular protein Degradation (CRED)と名づけた(図右)。
今回、研究グループは、クラステリンという細胞外分子シャペロンに着目して解析したところ、細胞外で変性した異常タンパク質が生じると、クラステリンが特異的に結合して捕まえることを見出しました。また、クラステリンが取り込まれると細胞が蛍光を発する手法を開発することで、クラステリンと異常タンパク質の複合体を細胞が取り込み、分解酵素を含む細胞小器官リソソーム内に運ばれて分解されることも判明しました。
2. ヘパラン硫酸受容体がクラステリン-異常タンパク質複合体を受容
続いて、研究グループ独自のクラステリン取り込み細胞が蛍光を発する手法と、CIRSPRによる遺伝子欠損細胞を組み合わせ、クラステリン分解能を欠損した変異体細胞を探索したところ、ヘパラン硫酸受容体の同定に成功しました。ヘパラン硫酸受容体は、線状の多糖類であるヘパラン硫酸基をもつ細胞表面の受容体タンパク質であり、増殖因子やウイルスの受容体となることが知られていましたが、異常タンパク質の受容体になっていることが今回初めて実証されました。
さらに詳細な解析から、細胞外の異常タンパク質が細胞に取り込まれるまでの一連の除去システムが明確になり、クラステリン-異常タンパク質複合体は、細胞表面のヘパラン硫酸受容体との直接結合によって捕らえられ、細胞内に取り込まれていることが明らかになりました。また、アルツハイマー病のリスク因子であるアミロイドβと結合したクラステリン複合体も、同様の除去システムによって分解できることと共に、この除去システムはほとんどの細胞種がもつ普遍的な機能であることがわかりました。研究グループは、このシステムをChaperone and Receptor mediated Extracellular protein Degradation (CRED)と名づけました。
雑誌名:Journal of cell biology
DOI: https://doi.org/10.1083/jcb.201911126
http://www.chiba-u.ac.jp/general/publicity/press/files/2019/20190823lysosome.pdf

本研究の概要図
A)異常なタンパク質の蓄積はタンパク質凝集体形成を促進し様々な疾患の原因となる(図左下)。
B)クラステリンと結合した異常タンパク質は、ヘパラン硫酸基を持つヘパラン硫酸受容体によって捕らえられ、細胞内で分解される。この血液内の異常タンパク質を分解する一連のシステムを発見し、Chaperone and Receptor mediated Extracellular protein Degradation (CRED)と名づけた(図右)。
- 研究の背景
- 研究の成果
今回、研究グループは、クラステリンという細胞外分子シャペロンに着目して解析したところ、細胞外で変性した異常タンパク質が生じると、クラステリンが特異的に結合して捕まえることを見出しました。また、クラステリンが取り込まれると細胞が蛍光を発する手法を開発することで、クラステリンと異常タンパク質の複合体を細胞が取り込み、分解酵素を含む細胞小器官リソソーム内に運ばれて分解されることも判明しました。
2. ヘパラン硫酸受容体がクラステリン-異常タンパク質複合体を受容
続いて、研究グループ独自のクラステリン取り込み細胞が蛍光を発する手法と、CIRSPRによる遺伝子欠損細胞を組み合わせ、クラステリン分解能を欠損した変異体細胞を探索したところ、ヘパラン硫酸受容体の同定に成功しました。ヘパラン硫酸受容体は、線状の多糖類であるヘパラン硫酸基をもつ細胞表面の受容体タンパク質であり、増殖因子やウイルスの受容体となることが知られていましたが、異常タンパク質の受容体になっていることが今回初めて実証されました。
さらに詳細な解析から、細胞外の異常タンパク質が細胞に取り込まれるまでの一連の除去システムが明確になり、クラステリン-異常タンパク質複合体は、細胞表面のヘパラン硫酸受容体との直接結合によって捕らえられ、細胞内に取り込まれていることが明らかになりました。また、アルツハイマー病のリスク因子であるアミロイドβと結合したクラステリン複合体も、同様の除去システムによって分解できることと共に、この除去システムはほとんどの細胞種がもつ普遍的な機能であることがわかりました。研究グループは、このシステムをChaperone and Receptor mediated Extracellular protein Degradation (CRED)と名づけました。
- 研究者のコメント
- 研究プロジェクトについて
- 論文情報
雑誌名:Journal of cell biology
DOI: https://doi.org/10.1083/jcb.201911126
- 過去の関連プレスリリース
http://www.chiba-u.ac.jp/general/publicity/press/files/2019/20190823lysosome.pdf
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
