細胞の中で自発的に内封物を放出するナノカプセルを開発~mRNAを用いた遺伝子治療の実現を加速~
千葉大学大学院薬学研究院 田中浩揮 特任助教と秋田英万 教授を中心とする共同研究チームは、日油株式会社と共同で、細胞の中に取り込まれたあと自らを分解する反応(自己分解反応)を起こす新素材(ssPalmO-Phe)を開発しました。本素材は脂質ナノカプセルを形成し、細胞内の環境に応じて内封した薬物を効率的に送達することが可能になります。様々な薬物を疾患の標的細胞まで届けるDrug Delivery System(DDS)での応用が期待され、特に、核酸を基盤とする遺伝子治療(注1)や個別化医療(注2)の実現を大幅に加速すると期待されます。この成果は「Advanced Functional Materials」にて2020年6月23日に公開されました。
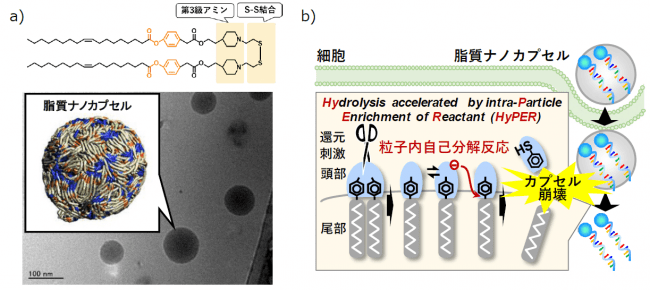 図1 a)本研究で開発した素材(ssPalmO-Phe)の化学式(上)、電子顕微鏡像及び分子シミュレーションにより計算された粒子モデル(下)。b)本素材からなる脂質ナノカプセルは、細胞内の環境においてのみ自己分解して内封分子を放出する。
図1 a)本研究で開発した素材(ssPalmO-Phe)の化学式(上)、電子顕微鏡像及び分子シミュレーションにより計算された粒子モデル(下)。b)本素材からなる脂質ナノカプセルは、細胞内の環境においてのみ自己分解して内封分子を放出する。
- 研究の背景
- 研究成果
ssPalmO-Pheを用いて細胞の中に緑色蛍光タンパク質のmRNAを導入すると、市販の試薬と比較して、均一かつ高効率なタンパク質導入が緑色の蛍光として観察されました(図2a)。また、mRNAをマウスに対して静脈内から送達すると、肝臓で高いタンパク質の発現が認められました(図2b)。
続いて本研究ではCRISPR/Cas9システム(注5)を用いたマウス肝臓の遺伝子編集を行いました。本システムを用いて、家族性アミロイドポリニューロパチー(注6)の原因とされるトランスサイレチンの遺伝子を編集(破壊)すると、血液中のトランスサイレチンが95%以上減少することが明らかとなりました(図2c)。
これらの結果から、ssPalmO-Pheは細胞内の環境に応答して特殊な粒子内反応によって自己分解することでmRNAを標的細胞内へ効率的に送達可能な分子であり、生体に機能的なタンパク質を導入できることが示され、さらに、遺伝子治療の新たな用途としての遺伝子編集にも有用であることがわかりました。
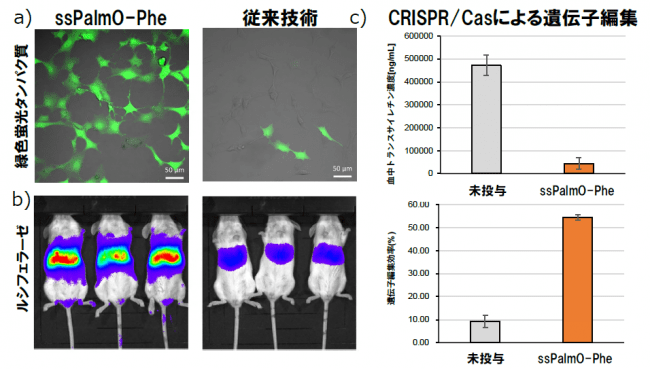 図2 a)タンパク質蛍光を従来技術と比較した結果。b)遺伝子発現量をルシフェラーゼの発光量で比較した結果。赤い方が発光量が多い。 c)CRISPR/Casによる遺伝子編集の結果。
図2 a)タンパク質蛍光を従来技術と比較した結果。b)遺伝子発現量をルシフェラーゼの発光量で比較した結果。赤い方が発光量が多い。 c)CRISPR/Casによる遺伝子編集の結果。
- 今後の展望
- 研究プロジェクト
・JST戦略的創造研究推進事業(CREST)
「リンパシステム内ナノ粒子動態・コミュニケーションの包括的制御と創薬基盤開発」
・千葉大学グローバルプロミネント研究基幹「千葉大発ナノDDSによるRNA創薬プラットフォームの実装」
・科学研究費補助金(17H06558、18K18377、20H00657)
・その他の研究助成(猪之鼻奨学会、旭硝子財団、武田科学振興財団)
- 用語解説
注2)個別化医療:患者個人が有する遺伝情報などに合わせて最適な治療法を選択することで行われるオーダーメイド型の医療。
注3)mRNA:リボヌクレオ核酸からなるポリマー上の分子で、通常は核内においてDNAから転写されることで生成し、細胞質でタンパク質へ翻訳される。本研究では細胞の外側で人工的に合成したmRNAを細胞の中へ導入し、生体にタンパク質を発現させた。
注4)HyPER(Hydrolysis accelerated by intra-Particle Enrichment of Reactant):HyPERではSS結合の分解で生み出されたチオール分子がナノカプセル内の極めて小さな空間に濃縮されることにより、ssPalmO-Phe内の別の結合(フェニルエステル結合)を更に分解する(図3a、b)。この反応は、通常の溶液状態では観察されず、形成されたナノカプセルの中でしか起きないため、化学的にもユニークな反応といえる。
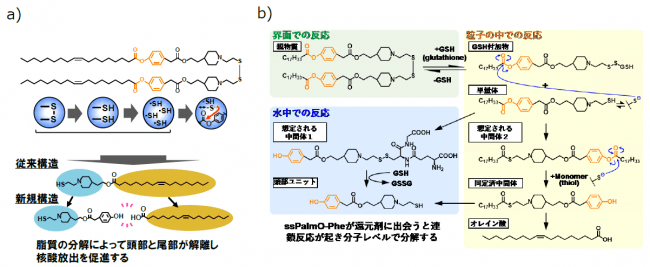 図3 a)本研究で開発したssPalmO-Pheの構造と分解反応(HyPER)の概略。b)ssPalmO-Pheの自己分解反応の反応機構。
図3 a)本研究で開発したssPalmO-Pheの構造と分解反応(HyPER)の概略。b)ssPalmO-Pheの自己分解反応の反応機構。
sgRNAと呼ばれる核酸をCas9と同時に細胞へ導入することで、sgRNAが認識するゲノム配列を切断することができる。
注6)家族性アミロイドポリニューロパチー:アミロイドと呼ばれる繊維状の物質が全身に沈着する(溜まる)病気。
なお、ssPalmO-Pheは日油㈱よりCOATSOME®SS-OPの製品名で販売されています。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
