発がん性タンパク質RASの活性を制御する新たな仕組みを発見 RASの活性型割合が細胞内環境下で低下していることをin-cell NMR法により観測
千葉大学大学院薬学研究院 西田紀貴 教授の研究グループは、独自に開発したバイオリアクター型の細胞内NMR観測法(in-cell NMR法)(※1)を用いて、細胞内でがんの主要な原因となるRASタンパク質の活性化の様子をリアルタイムで観測することに成功しました。また観測の結果から、細胞特有の環境要因によりRASの活性化が制御されることも明らかになりました。
本手法を用いることで、人工的に再現することが困難であった細胞内の環境におけるタンパク質の状態を直接評価できるようになるため、RASをはじめとした標的タンパク質、またはそのシグナル経路上流のタンパク質に対する阻害剤の細胞内での有効性を評価するために、本手法が応用されることが期待されます。
本研究成果は2020年8月26日(日本時間)に「Cell Reports」に掲載されました。
本手法を用いることで、人工的に再現することが困難であった細胞内の環境におけるタンパク質の状態を直接評価できるようになるため、RASをはじめとした標的タンパク質、またはそのシグナル経路上流のタンパク質に対する阻害剤の細胞内での有効性を評価するために、本手法が応用されることが期待されます。
本研究成果は2020年8月26日(日本時間)に「Cell Reports」に掲載されました。
- 研究の背景
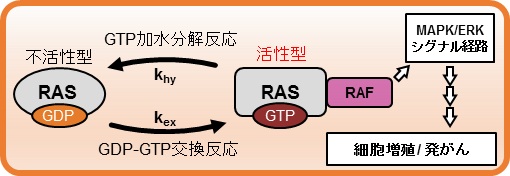 図1:RASのヌクレオチド結合サイクルと下流のシグナル伝達経路
図1:RASのヌクレオチド結合サイクルと下流のシグナル伝達経路
一方で、従来の細胞生物学的な手法では細胞内にあるRASの活性型割合を正確に定量・評価することは容易ではありませんでした。
- 研究手法:生細胞中における発がん性タンパク質RASの活性型割合リアルタイム観測
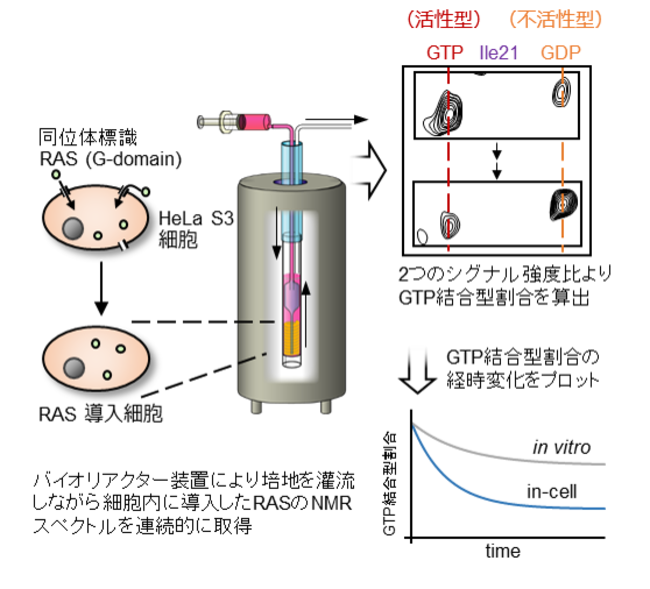 図2:リアルタイム細胞内NMR観測法と本研究での実験の概要
図2:リアルタイム細胞内NMR観測法と本研究での実験の概要
- 研究の成果
算出された活性型RASの割合は、in vitroよりも今回の装置を用いて計測した結果(in-cell)のほうが顕著に低いことが分かりました(図3(a))。またin-cellでは、活性型RASを不活性化するGTP加水分解速度がin vitroよりも高かった一方で、不活性型から活性型へ変換するGDP-GTP交換速度がin vitroよりも低いことが明らかになりました(図3(b)(c))。
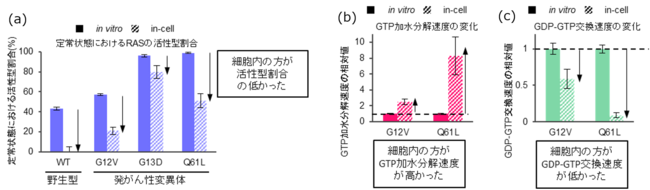 図3
図3
(a) RAS野生型(WT)および発がん性変異体 (G12V, G13D, Q61L)活性型割合をin vitroとin-cellで比較した結果。
(b),(c) in vitroとin-cell間における発がん性変異体(G12V, Q61L)のGTP加水分解速度(b)およびGDP-GTP交換速度(c)の比較(in vitroの値を基準)。
(2)細胞内の環境が活性化を制御する要因を特定
さらに研究グループは、in-cellとin vitroでの結果の違いが生じた要因を明らかにするために、細胞内の環境下で予測される様々な影響のうち、どの要因が活性型の割合低下に寄与しているのかを調べました。
その結果、高い溶液粘性がGDP-GTP交換速度を低くすること(図4(a))、および、特定の分子量(30~50kDa)の細胞内在性タンパク質の働きがGTP加水分解速度を上昇させること(図4(b))が明らかになりました。このタンパク質は、既にGTP加水分解速度を上昇させるタンパク質群として知られているものとは分子量などの点で異なっており、GTP加水分解速度を上昇させる未知のタンパク質が細胞内に存在することが示唆されました。
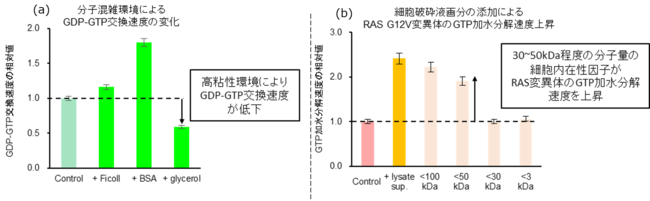 図4
図4
(a) 様々な分子混雑模倣環境下でのRAS(野生型)のGDP-GTP交換速度の変化。Ficoll:体積排除効果、BSA(ウシ血清アルブミン):非特異的相互作用、glycerol:溶液の粘性をそれぞれ再現。非添加時の値を基準。
(b) 細胞破砕液およびその分子量画分の添加によるRAS(G12V発がん性変異体)のGTP加水分解速度の変化。非添加時の値を基準。
- 今後の展望
- 論文情報
タイトル:Real-time In-cell NMR Reveals the Intracellular Modulation of GTP-bound Levels of RAS
雑誌名:Cell ReportsDOI: 10.1016/j.celrep.2020.108074
- 用語解説
- 研究プロジェクトについて
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
