抗体が糖ペプチドと結合する立体構造を明らかに ―生命科学で重要となる糖鎖構造の解明へ前進―
本研究は、抗体の糖ペプチド結合部位を初めて明らかにしただけでなく、IgG抗体(注3)は他の低分子型の結合分子と比較して、糖ペプチドのような大きく立体的なエピトープ(抗原認識部位)として認識できる優位性を示しています。
本研究成果は、2020年9月10日に英国科学雑誌「Biochemical and Biophysical Research Communications」にオンラインで公開されました。
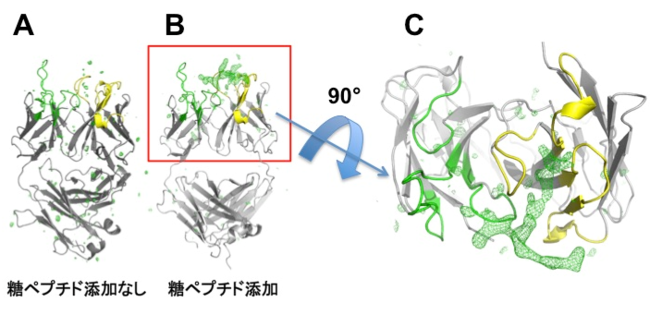 図1:抗体と糖ペプチドの結合部分の立体構造 相補性決定領域(重鎖(黄色)と軽鎖(緑))について、糖ペプチドを添加しないもの(A)と、添加したもの (B、C) の構造を比較した。B、Cにのみ緑色の網掛けで示す部分が観察され、糖ペプチドの結合の様子が示唆された
図1:抗体と糖ペプチドの結合部分の立体構造 相補性決定領域(重鎖(黄色)と軽鎖(緑))について、糖ペプチドを添加しないもの(A)と、添加したもの (B、C) の構造を比較した。B、Cにのみ緑色の網掛けで示す部分が観察され、糖ペプチドの結合の様子が示唆された
- 研究の背景と経緯
これまでに東北大学の加藤教授らは、次世代型抗体開発技術であるキャスマブ法(注5)を開発し、ポドプラニン (注6)に対するモノクローナル抗体を数多く作製してきました。その中には糖ペプチドが主要なエピトープである「糖ペプチド抗体」もあることが分かってきました。こうした糖ペプチド抗体の性質を利用し、タンパク質を修飾している糖鎖構造を明らかにすることで、糖鎖構造が関連する生命機能や疾病原因の解明が期待されます。しかしながら、糖ペプチドの大量調製はこれまで困難であり、抗体が糖ペプチドとどのようにして複合体を形成するのかは明らかとなっていませんでした。
- 研究の内容
まず、医化学創薬株式会社との共同研究により、化学的合成法と酵素学的合成法を組み合わせ、糖ペプチドを大量合成することに成功しました(図2)。
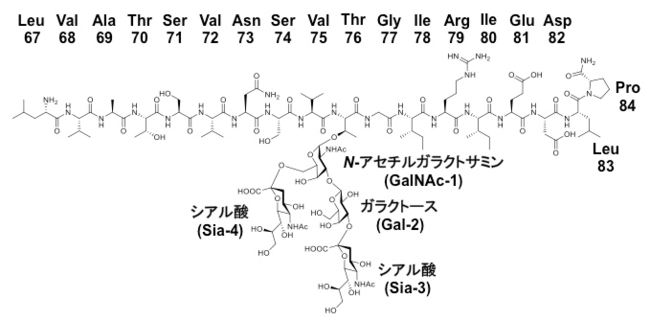 図2:合成した糖ペプチド 従来の固相化合成法に加え、糖転移酵素を用いて糖分子を付加した。3文字表記のアミノ酸の下の数字はポドプラニン中の残基番号を表す
図2:合成した糖ペプチド 従来の固相化合成法に加え、糖転移酵素を用いて糖分子を付加した。3文字表記のアミノ酸の下の数字はポドプラニン中の残基番号を表す
次に、LpMab-3のIgGから抗原結合部分のみを取り出したLpMab-3-Fabを生成し、これに合成した糖ペプチドを加えた条件と、加えない条件で結晶化を行い、得られた結晶についてX線結晶構造解析(注7)実験を行いました。その結果、糖ペプチドを加えて生成したLpMab-3-Fab結晶を2.8 Å(1 Å は10のマイナス10乗m)、糖ペプチドを加えないLpMab-3-Fab結晶を2.1 Åの分解能で構造決定することに成功しました(図1)。得られた構造を観察・比較した結果、糖ペプチドを加えたLpMab-3-Fabの結晶中に、糖ペプチドの結合が示唆される部分が見つかりました。
さらに研究チームは、この構造決定した形に基づいて、結晶中の糖ペプチド構造をモデリングしました(図3)。図2に示すように糖ペプチドの化学式は平面的な構造ですが、実際に得られた糖ペプチドの立体構造は、アミノ酸と糖鎖がT字型に繋がった立体的に大きな形でした。抗体中の抗原認識の性質を示す主要な部分がペプチド部分と糖部分の両方がうまくはまり込むようにくぼんだ構造をしており、直接結合していることが明らかになりました。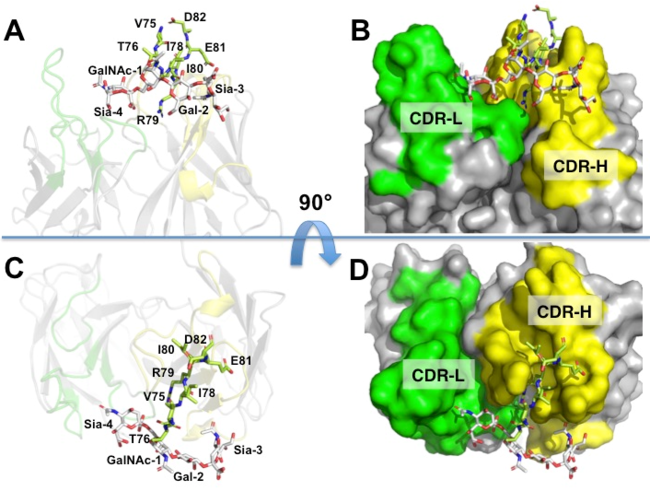 図3:糖ペプチドとLpMab-3-Fabの相互作用 黄緑色のスティックがアミノ酸残基、白色のスティックが糖分子を表す。アミノ酸は抗体中の重鎖(CDR-H)、糖は軽鎖(CDR-L)と結合している。AとBは横から、CとDは上から結合部を見た様子
図3:糖ペプチドとLpMab-3-Fabの相互作用 黄緑色のスティックがアミノ酸残基、白色のスティックが糖分子を表す。アミノ酸は抗体中の重鎖(CDR-H)、糖は軽鎖(CDR-L)と結合している。AとBは横から、CとDは上から結合部を見た様子
- 今後の展望・研究者のコメント
さらに、本研究で使用した抗体は、その抗原認識の機能を生かし、空間的に広がりを持つエピトープに対して巧みに結合することも明らかとなりました。近年、低分子型の抗体や抗体以外の結合分子も注目されていますが、これらに比べてIgG抗体には複雑で大きな抗原を認識することができる優位性を示す成果であると考えます。
- 用語解説
数〜十数個のアミノ酸(ペプチド)と、アミノ酸に結合した糖鎖分子からなる物質。化学的合成法と酵素学的合成法を組み合わせて合成する。
注2)モノクローナル抗体
1種類の細胞から生成される抗体。単一の抗原を標的にするという性質から、バイオマーカーとして有用とされてきたが、近年は研究のツールとしての役割を超え、最先端の医療において重要な医薬品としても期待される。2018年に京都大学の本庶佑氏がノーベル医学・生理学賞を受賞した抗PD-1抗体に代表されるがん免疫療法などが知られる。
注3)IgG抗体
免疫グロブリンG(Immunoglobulin G)抗体の略称。免疫グロブリンには、IgG、IgA、IgM、IgD、IgEの5種類あるが、IgGが血液中に最も多く含まれ、細菌や毒素と主に結合して生体の防御反応を担う。IgG抗体はY字型をしており、重鎖(50kDa)、軽鎖(25kDa)が2つずつで構成されている。
注4)糖鎖
グルコース、ガラクトース、マンノース、フコース、N-アセチルガラクトサミン、シアル酸などの糖が連なっている分子。生体内ではタンパク質や脂質に結合して様々な機能を果たす。ABO式血液型は赤血球上の糖鎖の違いによって決定している。
注5)キャスマブ法
がん細胞と正常細胞に同じ糖タンパク質が発現している場合、タンパク質に付加された糖鎖の種類の違いや糖鎖の付加位置の違いに着目し、その差を見分ける抗体を戦略的に樹立する抗体作製技術。
参考:東北大学プレスリリース「がん細胞だけを攻撃する抗体作製技術の開発~副作用のない抗体医薬品の開発が可能に~」
http://www.tohoku.ac.jp/japanese/2014/08/press20140729-01.html
注6)ポドプラニン
リンパ管マーカーとして用いられる分子で、非常に多く糖鎖修飾された糖タンパク質である。一方で悪性脳腫瘍、悪性中皮腫、肺がん、食道がん、卵巣がんなどで高発現し、がん細胞の浸潤や転移を引き起こすことが知られているため、抗体医薬の標的分子として期待される。
注7)X線結晶構造解析
解析対象のタンパク質を結晶化し、X線照射によって得られる回折データから、タンパク質の原子レベルでの立体構造を決定する手法。
- 研究支援
- 論文名および著者名
掲載誌:Biochemical and Biophysical Research Communications,
2020年9月10日オンライン公開
https://www.sciencedirect.com/science/article/pii/S0006291X20317022
著者:*Satoshi Ogasawara, Kano Suzuki, Kentaro Naruchi, Seiwa Nakamura, Junpei Shimabukuro, Nanase Tsukahara, Mika K. Kaneko, Yukinari Kato, *Takeshi Murata
(*責任著者).
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
