治療薬を包含した高分子ミセルの相互作用場を解明!優れた薬物送達のメカニズム理解への新手法
千葉大学大学院理学研究院の森田 剛 准教授、大学院医学薬学府博士課程3年の陳 子喬 氏、修士課程1年の向出 彩華 氏、大学院薬学研究院の東 顕二郎 准教授、森部 久仁一 教授、立命館大学生命科学部の今村 比呂志 助教、岡山大学異分野基礎科学研究所の墨 智成 准教授の研究グループは、優れた薬物送達作用を持つドラッグナノキャリアとして知られる高分子ミセルが、治療薬を取り込んだ状態での、システム中の相互作用場の解明に成功しました。これにより、従来の技術では困難であったナノキャリア間の集合や分散の状態を正確に把握することができるようになり、システムが特徴的に示す徐放性などの薬物送達作用の基本的メカニズムを理解することが可能となりました。本研究で用いた手法は、複雑な環境でのその場観測が可能であり、各種薬物への適用や体内条件での知見を得ることができるため、今後のドラッグナノキャリアの研究において、難溶解性薬物の薬理効果を高め、治療薬投与における身体的精神的な負担を軽減する技術の開発などへの貢献が期待されます。
- 研究の背景
 図1:高分子ミセルの概念図
図1:高分子ミセルの概念図
加えて重要な点として、一部の高分子ミセルは、投与された治療薬の患部への高選択な送達性や、体内血中での穏やかな薬物濃度の上昇、および、薬理効果が認められる薬物の濃度が長時間維持される特性を併せ持つ、優れた徐放性キャリア(注1)として知られています。薬物の徐放性は、治療薬による副作用の軽減や投与回数を減らすことにつながり、治療薬投与に際する負担を大きく和らげることができます。
優れた徐放性は、ミセル同士が形成する集合体の状態に深く関係しているため、ミセル間がどのような相互作用の場を持つか、この情報が基本的なメカニズムを理解する上で欠かせない知見でありますが、構造の複雑さのため、従来のモデル関数に基づく手法では正確な情報を得ることは困難であり、根本的な仕組みの理解には至っていませんでした。
- 研究成果
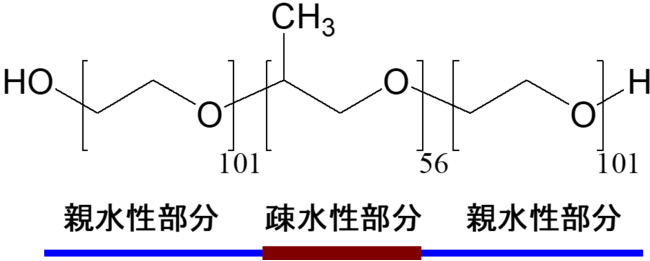 図2:ポロキサマー407の化学構造。親水性・疎水性部分の色分けは図1と対応
図2:ポロキサマー407の化学構造。親水性・疎水性部分の色分けは図1と対応
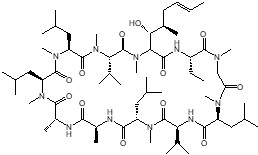 図3:シクロスポリンAの化学構造。11個のアミノ酸から構成される
図3:シクロスポリンAの化学構造。11個のアミノ酸から構成される
この知見に基づいて、本研究グループは、ポロキサマー407がシクロスポリンAを包含した薬物送達高分子ミセルの間に働いている相互作用や、薬物の包含による集合状態の変化を解明しました(図4)。この研究には、小角X線散乱法(注2)とよばれる実験手法とモデル関数に依存しない液体論(注3)に基づき、独自に開発した解析手法と解析理論が用いられました。ミセル間が接近した状態では、互いが離れようとする力(斥力)が大きく減衰しており、ミセル同士が徐々に引き離される集合状態にあることがわかりました。通常、高分子鎖間で互いが接近した場合、立体的な反発による大きな斥力が働きますが、逆の傾向を示しました。これが徐放性の起源と考えられます。また、高分子の濃度が高まると、柔らかく遠方まで引き合う力が働くことも明らかとなりました。これは、ミセル間で形成される安定な集合状態と関係があると理解されます。
さらに、図1で示される、低濃度域で特徴的に粒子間が引き離される現象について、単独で存在する高分子鎖の効果であることが、密度汎関数法による液体論に基づく粗視化モデル計算(注4)と動的光散乱法(注5)による解析から示されました。単独の高分子鎖は、系内に共存する粒子を、主に接近させる力を及ぼすと考えられていますが、ミセルを構成する高分子鎖そのものの効果において、粒子表面と高分子鎖に親和性がある場合、逆に引き離し、粒子の分散状態を安定化させることがわかりました。
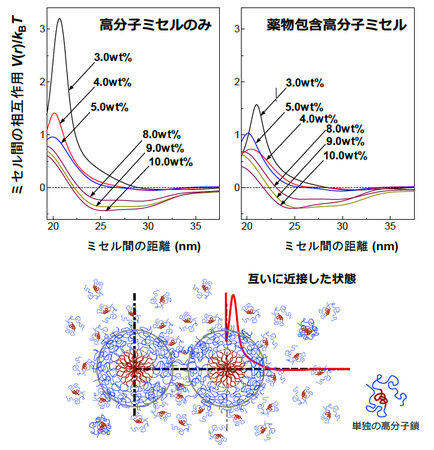 図4:本研究で初めて明らかとなった高分子ミセルや治療薬を包含した高分子ミセルの相互作用場 (上図グラフ)。下図は相互作用の様子をあらわしており、互いに接近した状態 (赤線は3wt%でのミセル間の相互作用データ)
図4:本研究で初めて明らかとなった高分子ミセルや治療薬を包含した高分子ミセルの相互作用場 (上図グラフ)。下図は相互作用の様子をあらわしており、互いに接近した状態 (赤線は3wt%でのミセル間の相互作用データ)
本研究成果に関する論文は、2021年2月10日に米国化学会誌Nano Lettersにて出版されました。
- 成果のまとめと今後の展望
- 用語解説
注2)小角X線散乱法:散乱される角度が数度程度の、非常に小さな角度域に生じる前方方向へのX線の散乱シグナルから、ナノマテリアルの形状や集合状態、構造の不均一ゆらぎなどの情報を得る手法。
注3)モデル関数に依存しない液体論:粒子間に働く引力や斥力に対し、近似・仮定や解析式などにより表されたモデル関数を導入せず、凝集状態での粒子間の構造などを表す理論。モデルーポテンシャルーフリー液体論とよばれる。
注4)粗視化モデル計算:複雑であるため、通常の扱いでは理解が困難な現象や構造に対して、共通構造部分を一体として扱い、あえて粗く構造体をとらえることにより解析を試みる研究手法。
注5)動的光散乱法:静的と動的な光散乱があり、動的光散乱では、例えば溶媒中での散乱体の動きに注目し、互いの相関が解消される時間の情報を測定することで、散乱体の動きやすさやストークス・アインシュタイン式により散乱体のサイズなどが解析される手法。
- 論文情報
雑誌名:Nano Letters
DOI:10.1021/acs.nanolett.0c03978
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
