バージャー病、膠原病により生じる難治性虚血性下肢潰瘍に対する細胞治療の医師主導治験を開始
~新たな治療選択肢の実現にむけて~
順天堂大学大学院医学研究科再生医学の田中里佳教授らの研究グループは、「バージャー病(*1)、膠原病により生じる難治性虚血性下肢潰瘍患者を対象としたRE-01(自己末梢血培養単核球細胞群)の複数回投与時の安全性及び有効性を検討する探索的試験」(jRCT2033220413)の治験届(*2)を独立行政法人医薬品医療機器総合機構(PMDA)に提出し、医師主導治験(*3)を開始することとなりましたのでお知らせします。
研究開発の背景
バージャー病や膠原病により生じる難治性虚血性下肢潰瘍は、血管炎や微小血管障害が主な原因となるため有効な治療法が無く、悪化すれば下肢切断を余儀なくされます。発症年齢が若いために難治性潰瘍により働き盛りの時期から生活困難となることも少なくありません。さらに潰瘍が悪化し下肢切断となった場合の予後は極めて悪くなります。QOL(Quality of Life:生活の質)の向上、生活困難性・医療費負担の軽減、早期の社会復帰のため、難治性潰瘍を改善し、切断を防ぐ有効な治療法の開発が切望されており、高いアンメットメディカルニーズ(*4)が存在します。
これまでの研究で、成人の末梢血単核球成分中に血管を再生させる細胞である血管内皮前駆細胞の存在が発見され(*5)、本細胞を用いた血管再生に関する様々な臨床試験が行われ、一定の安全性と有効性が報告されています。しかし、現在までに実施されている細胞を用いた血管再生治療は侵襲(*6)が高いこと、糖尿病患者や透析患者では血管内皮前駆細胞の数や血管・組織再生能が低下するため自己の細胞を用いた血管再生治療は十分な効果が得られないという課題があることから、より低侵襲的で簡便な方法で細胞が採取でき、より多くの機能的細胞を移植できる血管再生治療が必要とされています。研究グループでは、上記の課題に対し、少量の血液で多くの機能的な再生細胞を増幅できる培養法の開発を進めてきました(*7-8)。
治験製品(RE-01)について
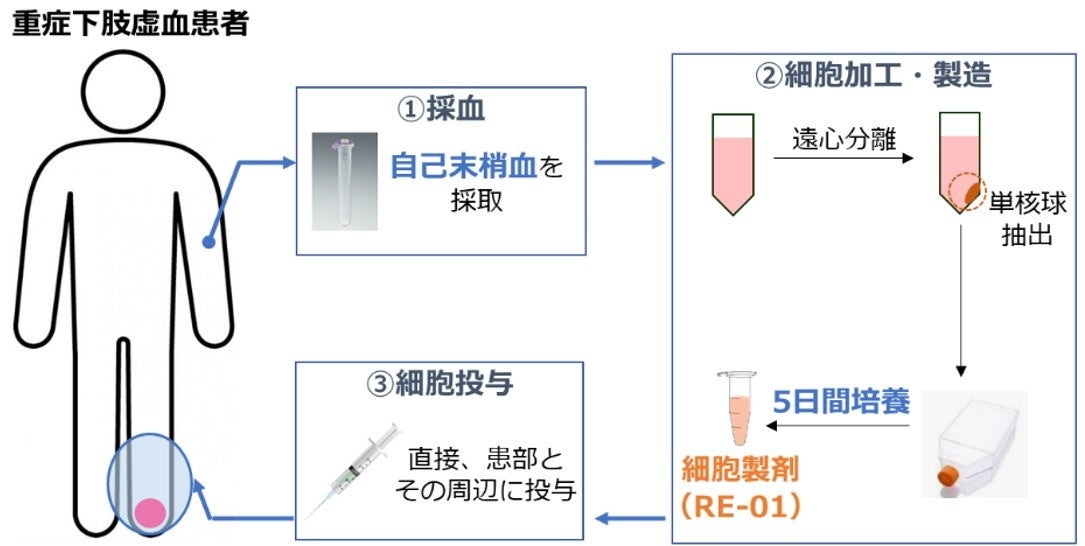
RE-01は、田中教授らの研究グループが開発した培養法を用いて作成される自己末梢血培養単核球細胞群です。血管内皮前駆細胞をはじめとする機能的な再生細胞を多く含んでいるため、血管新生・再生作用により微小血管を増やすことで組織中の血流量を増加させるだけでなく、抗炎症作用や創傷治癒を促す作用をもつことが確認されています。これらの複合的な作用により、炎症と虚血に起因する創傷を治癒することが期待され、血管炎による微小循環障害により生じるバージャー病、膠原病患者の難治性下肢潰瘍に対する新たな治療方法となりうると考えられています。また、患者に対する侵襲を100-200 mlの採血に留め、培養は培地交換や継代(*9)を行わず短期間で製造できるため、低侵襲・低コスト・高効果な血管・組織再生治療として期待されます。
治験の実施概要
本治験は、従来の薬物療法では効果が不十分で血行再建術が困難なバージャー病、膠原病により生じる難治性虚血性下肢潰瘍を有する患者さんに対して、RE-01を3回投与した時の安全性及び有効性を確認することを目的としています。
詳細は臨床研究等提出・公開システム(jRCT)(以下URL)にてご確認ください。
https://jrct.niph.go.jp/latest-detail/jRCT2033220413
用語解説・参考論文
*1 バージャー病:四肢の主幹動脈に閉塞性の血管全層炎を来す疾患です。特に下肢動脈に好発して、虚血症状として間欠性跛行や安静時疼痛、虚血性皮膚潰瘍、壊疽を来します。
*2 治験届:保健衛生上の見地から治験の実態を把握し、治験の安全性を確保するため、治験依頼者(製薬企業等)及び医師又は歯科医師(自ら治験を実施する者)は、厚生労働大臣への治験計画の届け出が義務づけられています。
*3 医師主導治験:医師自らが企画・立案し、治験計画届を提出して行うこと治験を医師主導治験といいます。医師主導治験では医師自らが、治験実施計画書等の作成から始まり、治験計画届の提出、治験の実施、モニタリングや監査の管理、試験結果を取りまとめた総括報告書の作成など、実施医療機関と協力しながら治験のすべての業務の実施並びに統括を行います。
*4 アンメットメディカルニーズ:いまだに治療法が見つかっていない疾患に対する医療ニーズのこと。具体的には、癌、認知症などの重篤な疾患のほか、不眠症や偏頭痛といった、生命に支障はないものの、QOL改善のために患者から強く求められている疾患に対する医療ニーズを指します。
*5 Asahara T et al: Isolation of putative progenitor endothelial cells for angiogenesis. Science 275:964–967, 1997
*6 侵襲:穿刺,切開,薬物投与,放射線照射, 心的外傷に触れる質問等によって,研究対象者の身体または精神に傷害または 負担が生じることを指します
*7 Masuda H et al: Vasculogenic conditioning of peripheral blood mononuclear cells promotes endothelial progenitor cell expansion and phenotype transition of anti-inflammatory macrophagez and T lymphocyte to cells with regenerative potential. J Am Heart Assoc. 3: e000743,2014
*8 Rica Tanaka et al: Phase I/IIa feasibility trial of autologous quality- and quantity-cultured peripheral blood mononuclear cell therapy for non-healing extremity ulcers. Stem Cells Transl Med. 11:146-158, 2022
*9 継代:培養系から培地を除去し、細胞を新しい培地に移す操作を指し、細胞系および細胞株がさらに増殖することを可能にする方法です。
バージャー病や膠原病により生じる難治性虚血性下肢潰瘍は、血管炎や微小血管障害が主な原因となるため有効な治療法が無く、悪化すれば下肢切断を余儀なくされます。発症年齢が若いために難治性潰瘍により働き盛りの時期から生活困難となることも少なくありません。さらに潰瘍が悪化し下肢切断となった場合の予後は極めて悪くなります。QOL(Quality of Life:生活の質)の向上、生活困難性・医療費負担の軽減、早期の社会復帰のため、難治性潰瘍を改善し、切断を防ぐ有効な治療法の開発が切望されており、高いアンメットメディカルニーズ(*4)が存在します。
これまでの研究で、成人の末梢血単核球成分中に血管を再生させる細胞である血管内皮前駆細胞の存在が発見され(*5)、本細胞を用いた血管再生に関する様々な臨床試験が行われ、一定の安全性と有効性が報告されています。しかし、現在までに実施されている細胞を用いた血管再生治療は侵襲(*6)が高いこと、糖尿病患者や透析患者では血管内皮前駆細胞の数や血管・組織再生能が低下するため自己の細胞を用いた血管再生治療は十分な効果が得られないという課題があることから、より低侵襲的で簡便な方法で細胞が採取でき、より多くの機能的細胞を移植できる血管再生治療が必要とされています。研究グループでは、上記の課題に対し、少量の血液で多くの機能的な再生細胞を増幅できる培養法の開発を進めてきました(*7-8)。
治験製品(RE-01)について
RE-01は、田中教授らの研究グループが開発した培養法を用いて作成される自己末梢血培養単核球細胞群です。血管内皮前駆細胞をはじめとする機能的な再生細胞を多く含んでいるため、血管新生・再生作用により微小血管を増やすことで組織中の血流量を増加させるだけでなく、抗炎症作用や創傷治癒を促す作用をもつことが確認されています。これらの複合的な作用により、炎症と虚血に起因する創傷を治癒することが期待され、血管炎による微小循環障害により生じるバージャー病、膠原病患者の難治性下肢潰瘍に対する新たな治療方法となりうると考えられています。また、患者に対する侵襲を100-200 mlの採血に留め、培養は培地交換や継代(*9)を行わず短期間で製造できるため、低侵襲・低コスト・高効果な血管・組織再生治療として期待されます。
治験の実施概要
本治験は、従来の薬物療法では効果が不十分で血行再建術が困難なバージャー病、膠原病により生じる難治性虚血性下肢潰瘍を有する患者さんに対して、RE-01を3回投与した時の安全性及び有効性を確認することを目的としています。
- 目標参加人数:3名
- 期間:2022年8月~2024年3月
- 実施医療機関:順天堂大学医学部附属順天堂医院
詳細は臨床研究等提出・公開システム(jRCT)(以下URL)にてご確認ください。
https://jrct.niph.go.jp/latest-detail/jRCT2033220413
用語解説・参考論文
*1 バージャー病:四肢の主幹動脈に閉塞性の血管全層炎を来す疾患です。特に下肢動脈に好発して、虚血症状として間欠性跛行や安静時疼痛、虚血性皮膚潰瘍、壊疽を来します。
*2 治験届:保健衛生上の見地から治験の実態を把握し、治験の安全性を確保するため、治験依頼者(製薬企業等)及び医師又は歯科医師(自ら治験を実施する者)は、厚生労働大臣への治験計画の届け出が義務づけられています。
*3 医師主導治験:医師自らが企画・立案し、治験計画届を提出して行うこと治験を医師主導治験といいます。医師主導治験では医師自らが、治験実施計画書等の作成から始まり、治験計画届の提出、治験の実施、モニタリングや監査の管理、試験結果を取りまとめた総括報告書の作成など、実施医療機関と協力しながら治験のすべての業務の実施並びに統括を行います。
*4 アンメットメディカルニーズ:いまだに治療法が見つかっていない疾患に対する医療ニーズのこと。具体的には、癌、認知症などの重篤な疾患のほか、不眠症や偏頭痛といった、生命に支障はないものの、QOL改善のために患者から強く求められている疾患に対する医療ニーズを指します。
*5 Asahara T et al: Isolation of putative progenitor endothelial cells for angiogenesis. Science 275:964–967, 1997
*6 侵襲:穿刺,切開,薬物投与,放射線照射, 心的外傷に触れる質問等によって,研究対象者の身体または精神に傷害または 負担が生じることを指します
*7 Masuda H et al: Vasculogenic conditioning of peripheral blood mononuclear cells promotes endothelial progenitor cell expansion and phenotype transition of anti-inflammatory macrophagez and T lymphocyte to cells with regenerative potential. J Am Heart Assoc. 3: e000743,2014
*8 Rica Tanaka et al: Phase I/IIa feasibility trial of autologous quality- and quantity-cultured peripheral blood mononuclear cell therapy for non-healing extremity ulcers. Stem Cells Transl Med. 11:146-158, 2022
*9 継代:培養系から培地を除去し、細胞を新しい培地に移す操作を指し、細胞系および細胞株がさらに増殖することを可能にする方法です。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
