生体内で安定して機能するアスタチン-211標識法を開発
より有効で安全な核医学治療への応用に期待
千葉大学、東京工業大学、大阪大学放射線科学基盤機構、量子科学技術研究開発機構高崎量子応用研究所の共同研究グループは、生体内で安定して機能するアスタチン-211 (211At)(注1)を用いる新しい標識法を開発しました。211Atはがんやバセドウ病などの治療で行われる核医学治療(注2)への応用が期待されるアルファ線(注3)という放射線を放出する原子であり、これまでに211Atを結合した様々な放射性薬剤が開発されています。しかし、従来の薬剤では生体への投与後に、211Atが脱離してしまうことに伴う正常組織への放射能集積が観察されており、副作用が懸念されていました。本手法により211Atと炭素の結合が安定化されたことから、今後より有効で安全な治療薬剤の開発への応用が期待されます。
本研究成果は、2021年10月28日(木)午後7時(日本時間)にJournal of Medicinal Chemistry誌に掲載されました。
本研究成果は、2021年10月28日(木)午後7時(日本時間)にJournal of Medicinal Chemistry誌に掲載されました。
- 研究の背景
しかし、生体内で安定した放射性ヨウ素の標識手法を211Atに応用した場合であっても、薬剤から211Atが脱離していました。脱離した211Atは、胃や甲状腺、脾臓などに集積することが知られており、このことにより正常組織における副作用が懸念されます。また、標的部位に集積した薬剤から211Atが脱離し、標的部位から流出することで治療効果が減弱することも懸念されます。このため、安定した211At結合分子を構築するための標識法の開発が望まれていました。
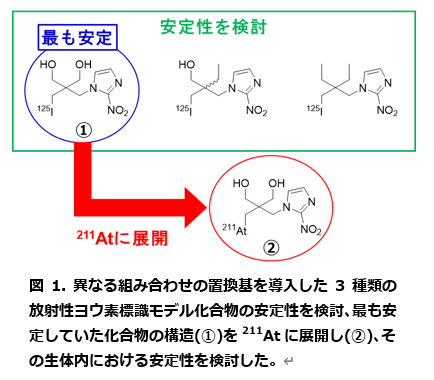
- 研究成果
続いて、211At標識化合物のマウス内での安定性を検証するために、標識化合物の体内動態を検討しました。まず、従来法で作製した211At標識化合物では、胃などの臓器に高い集積が観察されました(図2左赤線)。125I標識化合物では、このような集積は観察されませんでした(図2左青線)。さらに、尿中成分を分析することにより、尿中の放射能のほとんどは脱離した211Atであることを明らかにしました。一方、新しい標識法で作製した211At標識化合物では、胃などにおける集積量は非常に少ないことを明らかにしました(図2右赤線)。マウスの尿中からは脱離した211Atは観察されませんでした。さらに、対応する125I標識体と類似した体内動態を示すことも明らかにしました(図2右青線)。以上より、新しい標識法により生体内でも非常に安定的な211At標識化合物を合成できることが示されました。

- 今後の展望
- 研究プロジェクトについて
- ⽤語解説
(注2)核医学治療:体内に放射性核種を投与し、がんなどの標的部位に集積した後に放出される放射線によって治療を行う治療法のことです。標的部位に選択的に集積する性質を有する分子に放射性核種を結合(標識)した放射性薬剤、または放射性核種自体が標的に集積する性質を有する場合は、それ自体を放射性薬剤として使用します。
(注3)アルファ線:アルファ線は、その到達範囲が細胞数個分(0.1 mm未満)と非常に短く、ベータ線よりも選択的にがん細胞などの標的細胞を傷害します。また、その短い飛程において局所的に物質に非常に大きなエネルギーを与えることから、ベータ線よりも高い治療効果が期待できます。このような特徴から近年、アルファ線による核医学治療の利用が世界的に進められています。
(注4)ベータ線:エネルギーが高く、細胞を障害可能であることから、従来核医学治療に用いられてきた放射線です。その到達範囲は数mm程度であり、正常組織への影響は比較的少ないとされています。
(注5)ラジオセラノスティクス:同一、または体内動態が非常に類似した診断用、及び治療用放射性薬剤を用いて、診断と治療を一体化して行う医療や考え方のことです。患者個々の画像診断情報を基に治療を行うことができる他、治療効果の判定やその後の治療戦略の構築にも有用となります。
(注6)ネオペンチル構造:化学式 (CH3)3C-CH2- を母体とする構造であり、この構造にハロゲンを導入した場合、生体内脱ハロゲンの原因の一つである求核攻撃に対して高い安定性を示します。本研究では、3つあるメチル基の一つに2-ニトロイミダゾール基を導入したモデル化合物を作製し、検討に用いました。また、求核性分子による代謝以外に、シトクロム-P450によって代謝されることで生体内脱ハロゲンされる機構も想定されました。そこで、残り2つのメチル基に異なる組み合わせの置換基を導入した3種の放射性ヨウ素標識モデル化合物を作製し、シトクロム-P450代謝試験を実施しました。
(注7)シトクロム-P450:薬物の代謝に関与する代表的な酵素群の総称のことです。
(注8)求核性分子:自身は電子豊富であり、電子密度の低い原子に対して反応する性質を示す分子のことです。ヨウ素が結合した炭素は求核性分子の攻撃を受けやすい原子の代表例です。
- 論⽂情報
掲載誌:Journal of Medicinal Chemistry
著者名:Hiroyuki Suzuki, Yuta Kaizuka, Maho Tatsuta, Hiroshi Tanaka, Nana Washiya, Yoshifumi Shirakami, Kazuhiro Ooe, Atsushi Toyoshima, Tadashi Watabe, Takahiro Teramoto, Ichiro Sasaki, Shigeki Watanabe, Noriko S. Ishioka, Jun Hatazawa, Tomoya Uehara, Yasushi Arano
DOI:https://doi.org/10.1021/acs.jmedchem.1c01147
- 関連特許情報
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
