小児炎症性腸疾患の新たな原因が判明
~エピジェネティックなメカニズムによるSLCO2A1の発現抑制が原因に~
本研究成果は、Inflammatory Bowel Diseases誌のオンライン版に2023年6月16日付で公開されました。
本研究成果のポイント
臨床的に単一遺伝子が原因となるIBDが疑われた小児患者に、全エクソーム解析、DNAメチル化解析、RNA・タンパク発現解析、代謝産物測定などの機能解析を行った。
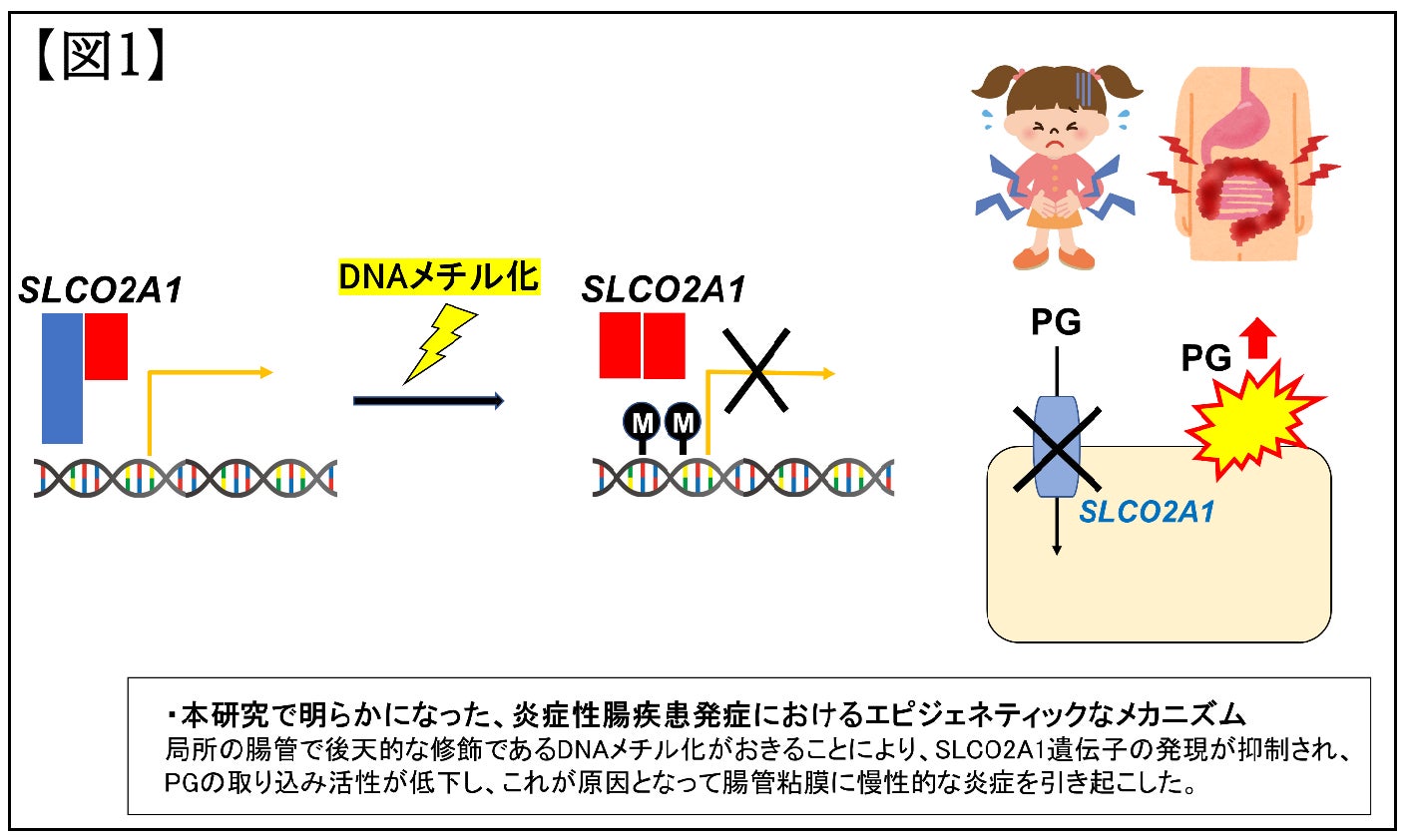
SLCO2A1の病的バリアントを片側アレルに有する患者で、腸管でDNAメチル化によるSLCO2A1の発現抑制が加わり、IBDを発症した可能性が示された。
IBD発症におけるエピジェネティック(*4)な変化に着目した新たな治療選択につながる。
背景
IBDの病因は遺伝的背景に加え、食生活や腸内細菌叢の変化などの環境要因が複雑に相互作用し発症に至ると考えられています。ごく若年の小児期に発症するIBDは遺伝学的要因が強いとされ、その中には一つの遺伝子の機能が阻害されて引き起こされる、いわゆるmonogenic IBDが含まれています。このようなIBDは薬剤による標準治療には抵抗性を認めることが多いため、その原因の特定は治療方針を策定する上で重要な情報となります。Monogenic IBDの原因遺伝子の一つであるSLCO2A1は、炎症メディエーター(生理活性物質)であるプロスタグランジンE2の細胞内取り込みを担うトランスポーターで、その働きが阻害されると慢性的に炎症が引き起こされます。SLCO2A1の遺伝子異常が、両親から受け継いだ遺伝子のいずれにも存在すると、浅い潰瘍が小腸に多発する非特異性多発性小腸潰瘍症というmonogenic IBDを発症します。近年、IBDの原因を特定するための遺伝学的検査が保険適応となりました。しかしながら、この検査では原因が特定できない小児のIBD患者も一定数見つかってきており、治療戦略を考える上で臨床上の大きな課題となっています。
内容 【図2】
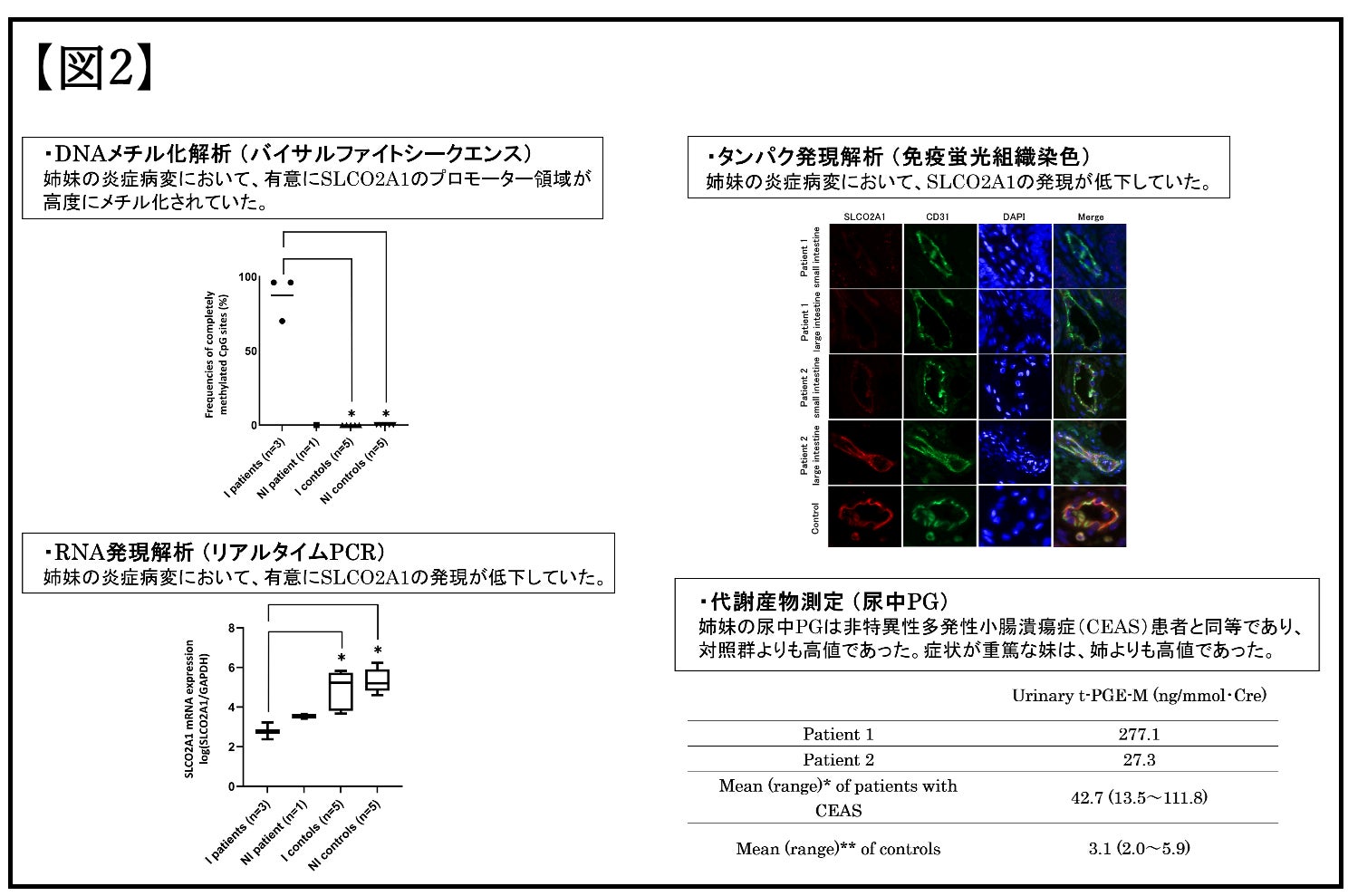
本研究では、若年で発症した姉妹IBD患者を対象としています。妹は2歳時に血便と下痢を発症し、内視鏡検査で大腸に散在するびらん(皮膚や粘膜の表皮が欠けたただれ)と、小腸に多発する潰瘍を認めました。姉は9歳時に周期的な腹痛と発熱を発症し、内視鏡検査で大腸は正常粘膜で、小腸に多発する潰瘍を認めました。遺伝学的要因の関与が疑われ、全エクソーム解析(遺伝子をコードする領域であるエクソンに由来するDNA分子だけを遺伝子解析する手法)で要因探索を行なったところ、いずれの症例でもSLCO2A1遺伝子の片側アレル(対立遺伝子)にスプライシングサイトバリアント(c.940+1G>A)を共通して検出しました。これまでSLCO2A1が原因となるIBDとしては、非特異性多発性小腸潰瘍症のみが知られていますが、この病気は両親から受け継いだ両側のアレルいずれにも病気の原因となる遺伝子の変化があるもので、この姉妹例は適合しません。SLCO2A1が遺伝学的要因以外で関与する可能性について検討するために、腸管の生検組織を用いて、後天的なDNAの修飾であるDNAメチル化解析(バイサルファイトシークエンス)を行いました。姉妹の炎症を起こしている病変においてのみ、このSLCO2A1の遺伝子発現を制御するプロモーター領域が高度にメチル化されていることが示されました。さらに、SLCO2A1のRNA発現解析(リアルタイムPCR)およびタンパク発現解析(免疫蛍光組織染色)を行ったところ、姉妹の炎症病変では、対照群と比較してSLCO2A1の発現が著しく低下していることを確認しました。このSLCO2A1は炎症を仲介するプロスタグランジン(PG) E2を細胞内に輸送するタンパク質であり、SLCO2A1の機能が低下するとPGの代謝が抑制され、細胞表面のPGのシグナル伝達が増加し炎症が誘発されます。代謝への影響を調べるために、尿中のPG代謝産物を測定したところ、姉妹いずれも非特異性多発性小腸潰瘍症の患者と同等であり、対照群よりも高値でした。さらに症状が重症な妹では、姉よりも高濃度のPG代謝産物が検出されました。これらの結果から本姉妹症例の発症メカニズムとして、腸管の細胞でDNAメチル化によりSLCO2A1の遺伝子発現が抑制されることにより、PGの取り込み機能が抑制され、高濃度のPGが腸管粘膜に慢性の炎症を引き起こした可能性が示されました。これにより、腸内細菌叢の変化や、食生活、運動などの環境要因等がSLCO2A1の遺伝子発現に影響し、腸管粘膜の炎症を引き起こす可能性が示されました。
今後の展開
これまでSLCO2A1が関与する炎症性腸疾患の原因としては、両親から引き継いだ両側アレルに病気の原因となるような遺伝子の変化のみが知られていました。今回の研究により、遺伝学的検査のみからでは原因が特定されなかった症例で、腸管の局所に後天的なDNAの修飾(DNAのメチル化)がおき、遺伝子発現が抑制され、PGの取り込み活性の低下を引き起こし、その結果としてIBD発症に至った可能性が示されました。SLCO2A1のDNAメチル化がどのようにして引き起こされたのか、まだ明らかになっていませんが、候補となる要因の一つとして腸内細菌叢の関与が考えられます。腸内細菌叢が乱れることにより一過性に炎症を引き起こし、これにより特定の遺伝子のDNAメチル化が亢進する可能性が考えられます。今回の結果から、保険適応となっている遺伝学的検査で原因が特定できなかった小児症例で尿中の代謝産物を測定する重要性が示されました。原因が特定されることにより、臨床経過が重症化した時にも、最適な薬剤を選択し治療を行えるものと考えられます。
用語解説
*1 炎症性腸疾患(IBD):inflammatory bowel disease、消化管粘膜に原因不明の慢性炎症を引き起こす疾患。近年、日本でも患者数が増加している。
*2 SLCO2A1遺伝子:単一遺伝子疾患による炎症性腸疾患の一つである非特異性多発性小腸潰瘍症の原因遺伝子。炎症メディエーターであるプロスタグランジンE2の細胞内への取り込みを担う。
*3 DNAメチル化:最もよく知られているエピジェネティック制御機構の一つ。DNA中の塩基の炭素原子にメチル基が修飾される化学反応。遺伝子発現の制御に関わるプロモーター領域で認められるCGの2塩基が密集している箇所(CpGアイランド)でこのメチル化が高度に起こると、その遺伝子の発現が抑制されることが知られている。
*4 エピジェネティック :DNAの塩基配列変化を伴わない遺伝子発現制御の仕組み。
研究者のコメント
ごく若年で発症するIBDは治療抵抗性などがあり、原因を特定し、適切な治療を施すことが重要です。
遺伝学的検査が保険適応となっていますが、それでは原因が特定できない症例が少なからず存在し、臨床的課題となっています。
本研究を通じて、代謝産物や遺伝子発現などの多角的なアプローチにより原因を特定することが重要であることが広く認知されることを期待します。
原著論文
本研究はInflammatory Bowel Diseases誌のオンライン版で(2023年6月16日付)先行公開されました。
タイトル: Attenuated expression of SLCO2A1 caused by DNA methylation in pediatric inflammatory bowel disease
タイトル(日本語訳): 小児炎症性腸疾患におけるDNAメチル化によるSLCO2A1の発現抑制
著者:Natsuki Ito,1,2 Takahiro Kudo,1 Hidetaka Eguchi,2 Keisuke Jimbo,1 Atsushi Furuhata,3 Toshiaki Okuno,4 Ichiro Takeuchi,5 Katsuhiro Arai,5 Takashi Ishige,6 Yasushi Okazaki,2 Toshiaki Shimizu,1
著者(日本語表記): 伊藤夏希1,2)、工藤孝広1)、江口英孝2)、神保圭佑1)、古旗淳3)、奥野利明4)、竹内一朗5)、新井勝大5)、石毛崇6)、岡﨑康司2)、清水俊明1)
著者所属:1) 順天堂大学大学院医学研究科 小児思春期発達・病態学、2)順天堂大学大学院医学研究科 難治性疾患診断・治療学/難病の診断と治療研究センター、3) 順天堂大学大学院医学研究科 研究基盤センター形態解析イメージング研究室、4)順天堂大学大学院医学研究科 生化学第一講座、5)国立成育医療研究センター 消化器科、6)群馬大学大学院医学系研究科 小児科学分野
DOI: 10.1000.333.444.doi,2000
本研究は2021年度 順天堂大学共同プロジェクト研究費(学内)(2021-39)ならびに国立成育医療研究センターの成育医療研究開発費の支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
