なぜわれわれの内臓は左右非対称なのか?
―体の左右を決める仕組みの解明―
発表者らは以前、分子モーターKIF3欠失マウスの研究を通して腹側ノード(注1)と呼ばれる胎児期の体の正中部にある凹みの中で、後方に倒れた一次線毛(注2)が高速で時計回りに回転することで左向きの胚体外液(注3)の流れ (ノード流) が生じることを同定しています (Nonaka et al., Cell 1998; Hirokawa et al., Cell 2006,他)。このノード流が線毛の後傾性と一定の回転方向によって左向きの方向性を生み出すことから、人体の左右対称性を初めて破る物理現象として注目されてきました。一方、内臓の非対称性(注4)の起源は、ノード左縁に特異的な細胞内カルシウム(注5)の線維芽細胞成長因子 (FGFs) に依存する上昇によるものと考えられますが (Tanaka et al., Nature 2005、他)、左向きのノード流がいかにしてノード左縁のカルシウム上昇をもたらすかという「読み出し」の機構は依然として不明のままでした。廣川特任教授、田中講師らはこれまで細胞内の微小管というレールの上で様々な蛋白質を輸送するキネシン分子モーター群 KIFs を発見するとともに、それぞれの KIF 遺伝子をマウスで欠失させ、その働きを研究してきました。特に KIF3B マウスの研究からは、初期胚の左右非対称性を決定するノード流を発見するとともに、統合失調症や多指症を防ぐしくみの解明にも至りました。
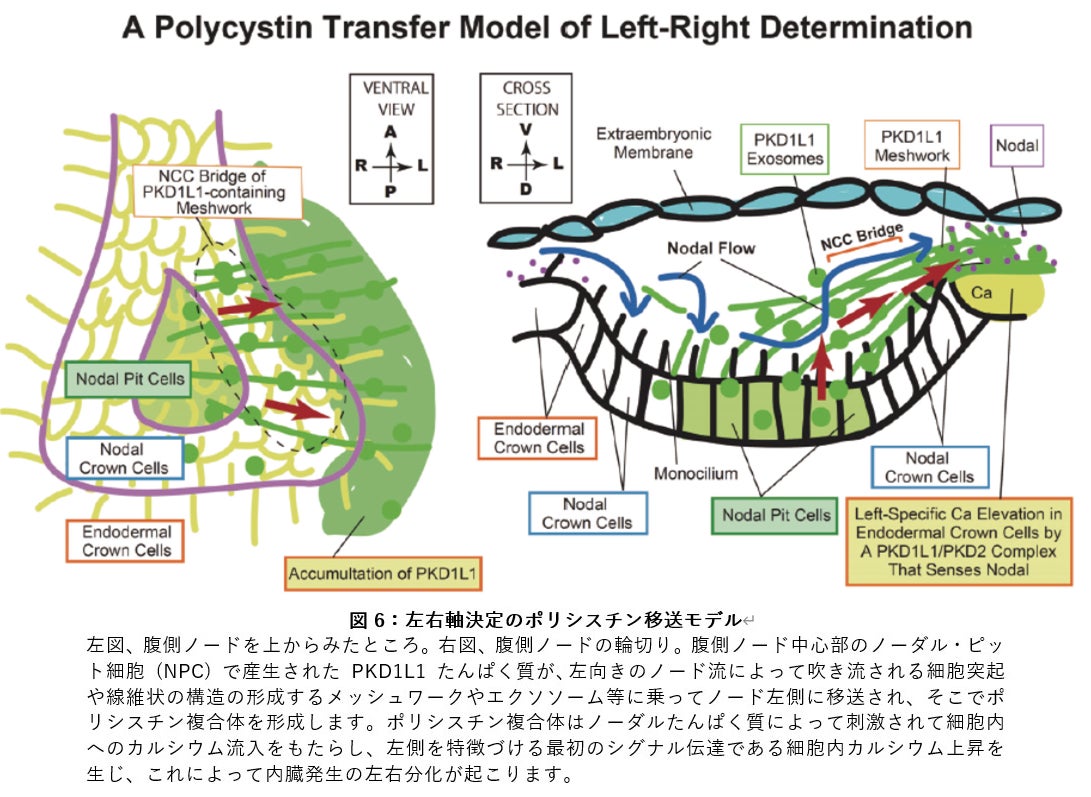
今回、発表者らがノード流の研究を深めるため、細胞内のカルシウム上昇に関係する PKD1L1 ポリシスチンたんぱく質(注6)を蛍光で光るようにしたマウスを作製したところ、腹側ノードの内部からノード左端に向かって、ポリシスチンを含む線維状の構造が撚り合わさった「橋」がかかり、ポリシスチンがノード内部から左向きに移送されていく現象を発見しました。さらにノード左側に集積したポリシスチンが、ノーダルたんぱく質(注7)と結合することによって、細胞内のカルシウム上昇が起こります。こうして、ノード流が腹側ノード左側特異的にカルシウム上昇をもたらす機構の存在が明らかとなりました。
本研究の成果は「いかにして体の左右が異なって発生するのか」という発生生物学の根源的な課題への一つの回答であり、分子発生生物学の発展に大きく寄与します。たんぱく質の細胞外への新しい特殊移送機構の解明は、これをターゲットとした抗がん剤の開発など、種々の臨床応用も期待できます。
発表のポイント
PKD1L1 と呼ばれるポリシスチンたんぱく質の載った細胞外の糸状の構造が撚り合わさり、ノード流によって左に吹き流される機構を、マウス胚の蛍光観察によって発見しました。
左右非対称の胚の発生を開始させるメカニズムとして、ポリシスチンが腹側ノード左縁部に集まりノーダルたんぱく質と結合して活性化され、細胞内のカルシウムを左側で上昇させる機構を発見しました。
この発見は、なぜ体の左右が分かれるかという根源的な疑問を解くとともに、細胞外構造の新しい移送機構をターゲットとした抗がん剤の開発など、臨床応用にも道を開きます。
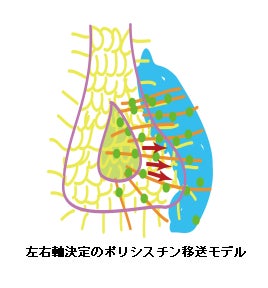
発表内容
〈研究の背景〉
わたしたちの内臓の左右非対称性は生命の維持に非常に重要な役割を果たしています。たとえば心臓の左心系と右心系が間違ってつながる大血管転位という心奇形は、血液の流れに大きな異常が生じ、出生時に緊急手術をしないと生きていけなくなります。このような内臓の左右非対称性がなぜ生じるのかは発生生物学の永年の謎でした。発表者らは以前、腹側ノード内での線毛回転により左向きのノード流が生じ、その結果として腹側ノードの左側のみで細胞内カルシウムが上昇して左側特異的なシグナル伝達を惹起するという経路を同定しました。この経路の大きなミッシングリンクとして、ノード流がカルシウム上昇を生み出す分子機構が未解明のままでした。今回、光変換可能な蛍光タンパク質 KikGR、CRISPR/Cas9システムによる遺伝子編集を用いた新しいマウスモデルの作成、全胚培養、共焦点顕微鏡観察などの先端的な技術を組み合わせることにより、このミッシングリンクをつなぐ新しい「ポリシスチン移送仮説」を提唱しました。
〈研究の内容〉
1.PKD1L1 ポリシスチンたんぱく質の左側シフト
細胞におけるたんぱく質の発現は、まず mRNA と呼ばれる「設計図」が作られ、次にそれからたんぱく質が作られ、場合によっては細胞の外に放出されて空間を移動します。そこでまず Pkd1l1 mRNA をホールマウント・イン・シチュ・ハイブリダイゼーションという方法で染色したところ、2-3体節期の胚において、腹側ノードなど正中線上のみに発現が観察されました。しかし、PKD1L1 たんぱく質を免疫染色したところ、腹側ノードの左側にはみ出すような染色像が得られました (図1)。このことは、正中部にある腹側ノードでつくられた PKD1L1 たんぱく質がノード流に乗って左側に移送している可能性を示唆しています。実際、Pkd1l1 遺伝子の両端に蛍光たんぱく質のタグをつけたものを細胞に発現させると、培地中の細胞外小胞に PKD1L1 たんぱく質が濃縮されて分泌され、そのたんぱく質の一部は、さらに中央で切断されることもわかりました。
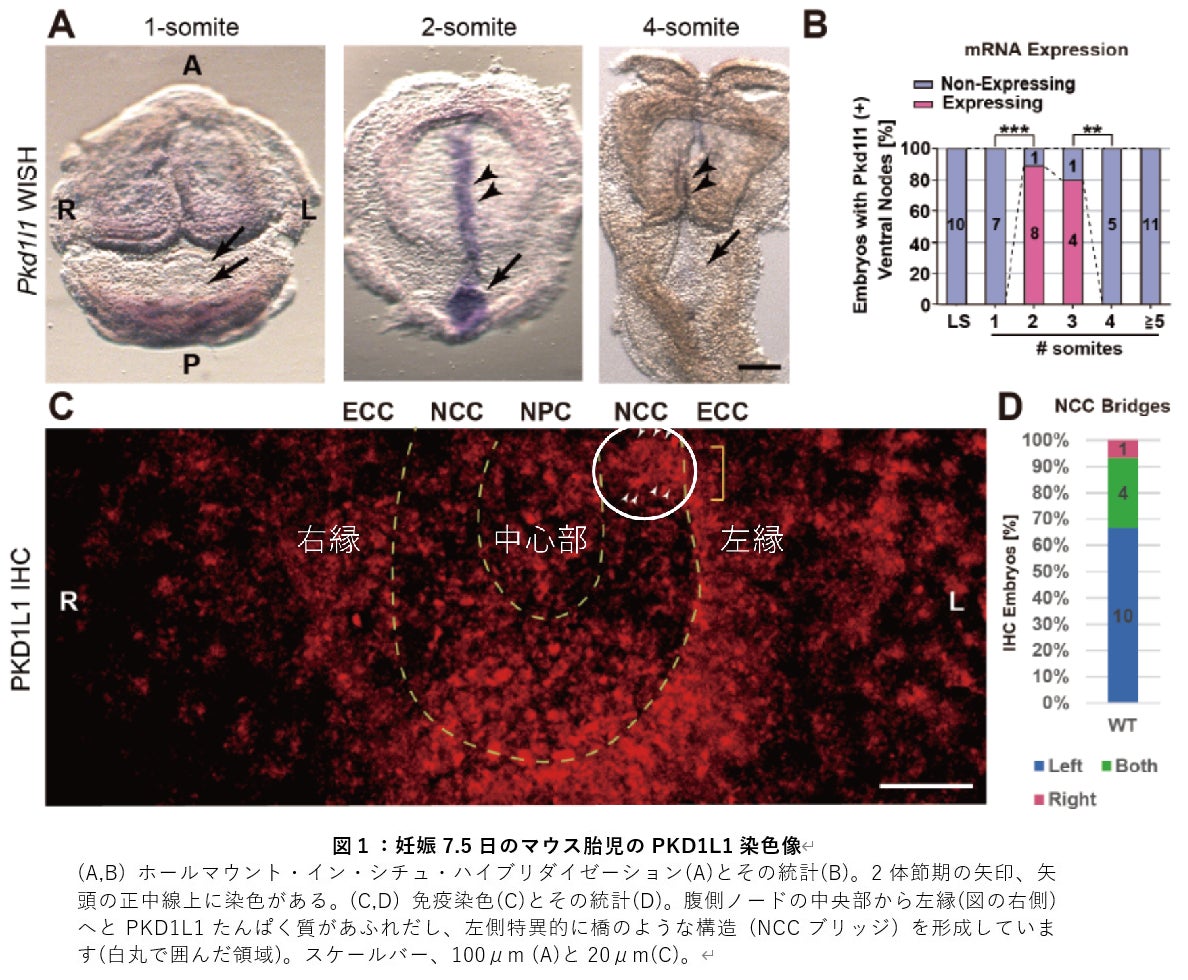
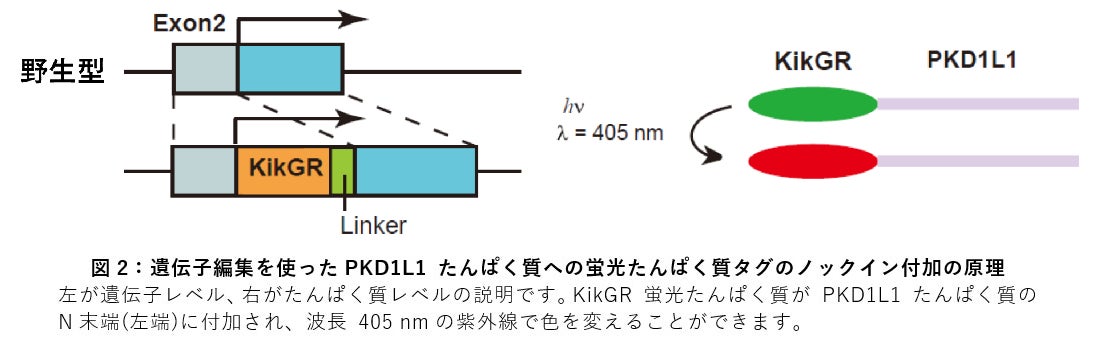
2.マウス胚におけるPKD1L1 ポリシスチンたんぱく質の蛍光ラベリング
CRISPR/Cas9 法を用いて、マウス受精卵のゲノム編集を行い、PKD1L1 たんぱく質のN末端にKikGR 蛍光たんぱく質を融合して発現させることに成功しました。このノックインマウスは特に大きな発生の異常もなく、個体内のPKD1L1 たんぱく質がすべて蛍光で光ってみえるようになっています。さらにこの KikGR たんぱく質は紫外線の照射で緑色から赤色へと変化しますから、ある部位のみに紫外線を照射して色を変えておけば、その部分の PKD1L1 たんぱく質がその後どうなるか追跡することができるというわけです (図2)。
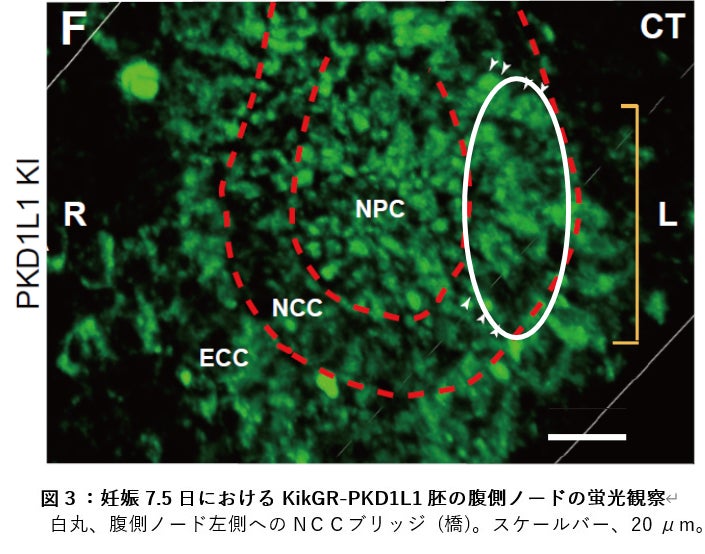
3.KikGR-PKD1L1 ノックインマウス胚の蛍光観察
そこでこの胚を蛍光観察してみると、KikGR-PKD1L1 たんぱく質の蛍光は、免疫染色に一致して、腹側ノードの中心部から橋のような構造を通じて左側にあふれ出していることがわかりました(図3)。FGF シグナリング阻害剤 SU5402 で処理するとこの橋がなくなり、さらにソニック・ヘッジホッグを加えると橋が復活することもわかりました。以前の結果で、ノード左側でカルシウムが上昇する現象が SU5402 処理で消失し、またソニック・ヘッジホッグの添加で復活することを示していますが (Tanaka et al., Nature 2005)、今回の橋の消失と復活は、このことともきれいに一致しました。したがって、おそらくこの橋を介して PKD1L1 たんぱく質がノード左側に移送され、カルシウム上昇を媒介しているものと考えられます。
4.PKD1L1 ポリシスチンたんぱく質の左向き移送の可視化
この胚において、腹側ノードに発現している KikGR-PKD1L1 たんぱく質の蛍光を緑色から赤色に光変換した後、1時間強にわたり、蛍光顕微鏡の上で撮影しました。その結果、腹側ノード内で赤色に変化した KikGR-PKD1L1 たんぱく質が徐々に左側にシフトして、ノードの左側に移送されていくようすを観察することができました (図4)。
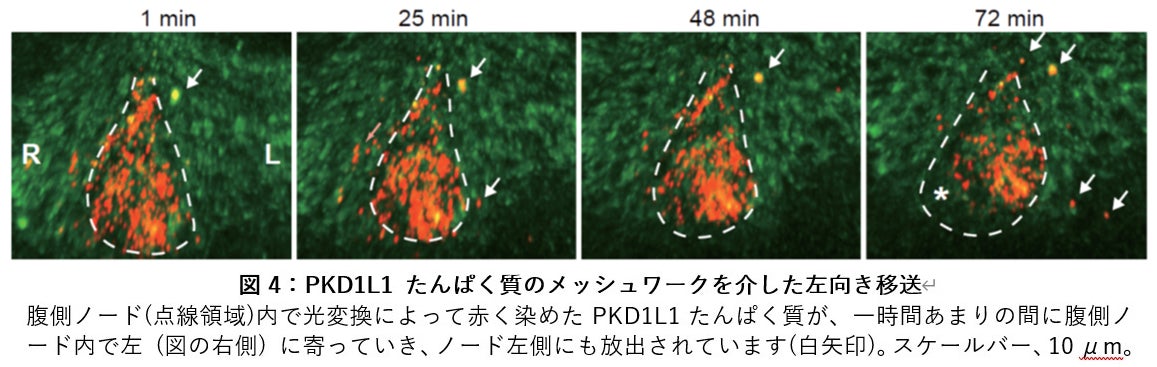
これらの観察は、腹側ノードを覆っている胚体外膜があると蛍光が散乱してしまうため、それを除去した標本で行ってきました。しかし実際のところは、この胚体外膜は、腹側ノードの中に、比重の高い溶液をとどめておき、PKD1L1 の移送を助ける役割を果たしていると考えられます。そこで、胚体外膜越しに腹側ノードを観察したところ、腹側ノードの床はメッシュ状の構造で底上げされており、その空隙の部分から胚体外液が出入りしてノード流を整えていることがわかりました。この状態できれいに胚を固定してから胚体外膜を除去すると、蛍光たんぱく質を含む網状の構造の存在が観察され、また電子顕微鏡でもその一部が可視化されました。すなわち、腹側ノードからPKD1L1を含んだ線維状の構造がノード流により左に吹き流されていくとともに、その線維が互いに撚り合わさってメッシュワークを作り、ノード流を構造的に安定化していることがわかりました。
5.ポリシスチンたんぱく質はノーダルたんぱく質に刺激され細胞内にカルシウムを増やす
それでは、以上のようなノード流内のファイバーの吹き流しにより、腹側ノード左側に移送されたポリシスチンたんぱく質は、どのようにして活性化され、細胞内カルシウム上昇を引き起こすのでしょうか?
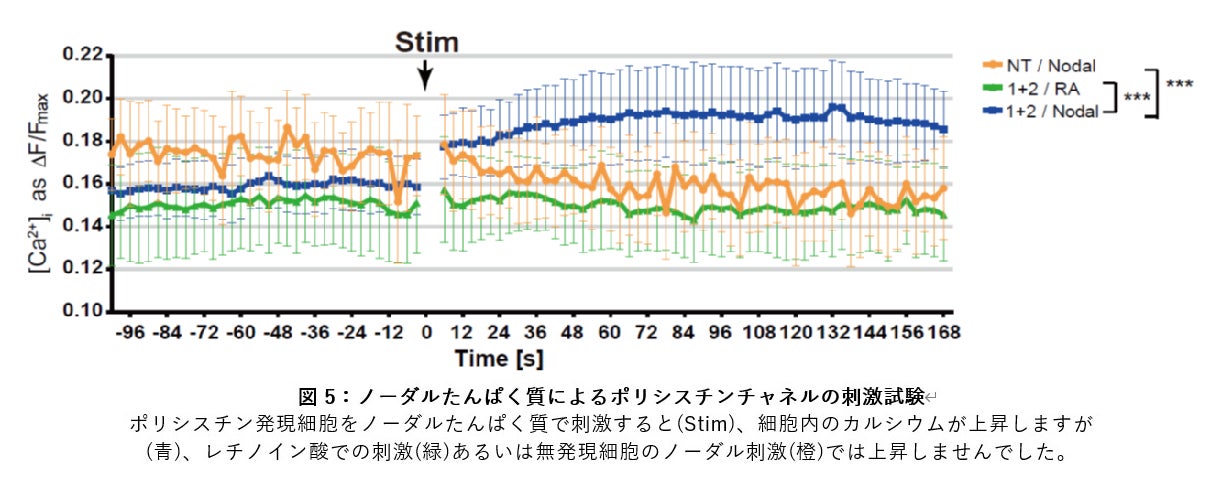
まず腹側ノードの免疫染色と近接ライゲーションアッセイの結果から、ノード左縁で PKD1L1 ポリシスチンたんぱく質は、ノーダルたんぱく質と結合していることがわかりました。そこで、ノーダルたんぱく質がポリシスチンレセプターチャネルの新たなリガンドなのではないかと考え、線維芽細胞に PKD1L1/PKD2 ポリシスチンを共発現して、ノーダルたんぱく質で刺激してみました。細胞のカルシウム上昇を蛍光指示薬で可視化して定量すると、ノーダルたんぱく質による刺激に伴って、共発現細胞のカルシウムがみごとに上昇しました。この上昇はポリシスチンが発現していない細胞では起こらず、また発現している細胞も、レチノイン酸などによる他の刺激では応答しませんでした(図5)。従ってノーダルたんぱく質が左側に移送されたポリシスチンに結合することでポリシスチンチャネルが開口し細胞内へのカルシウム流入が生じるという、新しい仕組みが示唆されました(図6)。
〈今後の展望〉
学術的意義
本研究は、発生生物学の永年の疑問である「いかにして内臓の左右軸が決定されるのか」について、新たなポリシスチン移送モデルを提唱し、クリアカットな解答を与えることができました。これまで発生生物学の分野では分子細胞レベルの解析が遅れていましたが、キネシンスーパーファミリー分子モーターの分子遺伝学的研究から、このような発生生物学の根本原理の一つにまでたどり着いた、非常に意義深い学際的発見です。
社会的意義
現在、細胞外構造の新しい移送機構は発がんの分野でもトピックとなっており、固形がんがエクソソームの分泌・結合を介して悪性化するなど、多くの新事実が発見されつつあります。本研究の成果は、細胞外のメッシュワークに関係した新しいたんぱく質の細胞外移送機構を示唆するもので、これをターゲットとしたまったく新しい視点の抗がん剤の開発などの臨床応用が期待されます。
〈関連のプレスリリース〉
「なぜ指は5本になるのか? 体の座標を決める仕組みの解明」(2022/10/10)
https://www.u-tokyo.ac.jp/content/400198364.pdf
「ベタインはキネシン分子モーターの機能低下による統合失調症様の症状を改善する」
(2021/4/14)
https://www.m.u-tokyo.ac.jp/news/admin/release_20210414.pdf
用語解説
注1 腹側ノード
初期胚の下腹部に相当する部分に一時的に生じる中胚葉性の器官で、体の正中にある体表の凹みの底に小型の細胞が集まってできています。
注2 一次線毛
細胞表面に生じる長い突起の一種であり、特にひとつの細胞に一本が生える形式のものをいいます。水流の発生ならびに細胞のシグナル伝達に関係していると考えられています。
注3 胚体外液
初期胚を包む液体の総称で、比重が高く粘度も高いものです。これまでの論文では、これを包む胚体外膜を開放して腹側ノードを観察していましたが、今回の論文では、胚体外膜をあえて開放しないまま顕微鏡に載せることで、胚体外液にくるまれた細かい線維のメッシュワークを観察することに成功しました。
注4 内臓の非対称性
右肺は三葉ですが左肺は二葉、心臓の右心系は肺循環に、左心系は大循環に血液を拍出し、上部消化管は頭方からみて90度右にねじれることで胃・肝臓・膵臓・十二指腸の左右非対称性が完成し、下部消化管は一度臍帯中に脱出して270度よじれることで腸のループ構造が生じ、横行結腸が十二指腸の前側をクロスして横切り、その内容物が右から左に向かって通過するようになる、などの左右非対称性の存在が知られています。
注5 細胞内カルシウム
すべての細胞は、表面にあるカルシウムポンプの作用により、カルシウムイオンを細胞外に汲み出し続けています。そのため、細胞内のカルシウムイオン濃度は、細胞外に比べて1万分の1程度に抑えられています。細胞が種々の理由で興奮するとき、表面のカルシウムチャネルが開口し、カルシウムイオンが細胞内に流入して細胞内カルシウム濃度を一過性に上昇させます。すると、カルシウム依存性のたんぱく質リン酸化酵素やホルモンの分泌装置など、細胞のふるまいを変えるシグナル伝達の機構が活性化されます。
注6 PKD1L1 ポリシスチンたんぱく質
ポリシスチンは細胞表面のカルシウムチャネルの一種で、一般的に、細胞膜の張力変化あるいはリガンドたんぱく質の結合によって活性化されます。PKD1L1 たんぱく質は腹側ノードに発現されているポリシスチンの構成サブユニットで、PKD2 たんぱく質とともにポリシスチン複合体を作ります。その遺伝子が変異した魚類、マウス、ヒト家系などでは、腹側ノード左縁のカルシウム上昇現象の異常により、左右非対称な内臓の発生に変異が生じます。しかし、PKD1L1/PKD2 ポリシスチンがどのようにして活性化するかは、これまでほぼ不明でした。
注7 ノーダルたんぱく質
TGFβファミリーに属するがん遺伝子のひとつで、発生初期の腹側ノードの周縁に発現し、左右軸の決定に重要な役割を果たしています。発生の後期では腹側ノード左縁に強く発現するようになりますが、ノード流が生じる 2~3 体節期にはほとんどまだ左右差がなく、それがどのように左右軸決定にかかわっているかは、今回の論文以前には明らかになっていませんでした。
論文情報
〈雑誌〉Developmental Cell 2023年8月21日号 (電子版 7月5日付)
〈題名〉Nodal flow transfers polycystin to determine mouse left-right asymmetry
〈著者〉Yosuke Tanaka†, Ai Morozumi†, Nobutaka Hirokawa (†Equal contribution)
研究助成
本研究は、科研費 (JP23000013、JP16H06372、JP22K06246:廣川)、日本電子寄附金 (廣川)、東京大学GAPファンド (第8期、第12期:田中)、AMED橋渡し研究シーズA (JP23ym0126805:田中) の支援により実施されました。
〈参考文献〉
Hirokawa N, Tanaka Y, Okada Y, Takeda S (2006) Nodal flow and the generation of left-right asymmetry. Cell 125: 33-45
Nonaka S, Tanaka Y, Okada Y, Takeda S, Harada A, Kanai Y, Kido M, Hirokawa N (1998) Randomization of left-right asymmetry due to loss of nodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein. Cell 95: 829-837
Tanaka Y, Okada Y, Hirokawa N (2005) FGF-induced vesicular release of Sonic hedgehog and retinoic acid in leftward nodal flow is critical for left-right determination. Nature 435: 172-177
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
