人工知能を駆使し、新しいたんぱく質品質管理の仕組みを解明
―発達・てんかん性脳症発症機構の解明にも繋がる成果―
本論文はScience Advances誌のオンライン版に2023年8月18日付で公開されました。
本研究成果のポイント
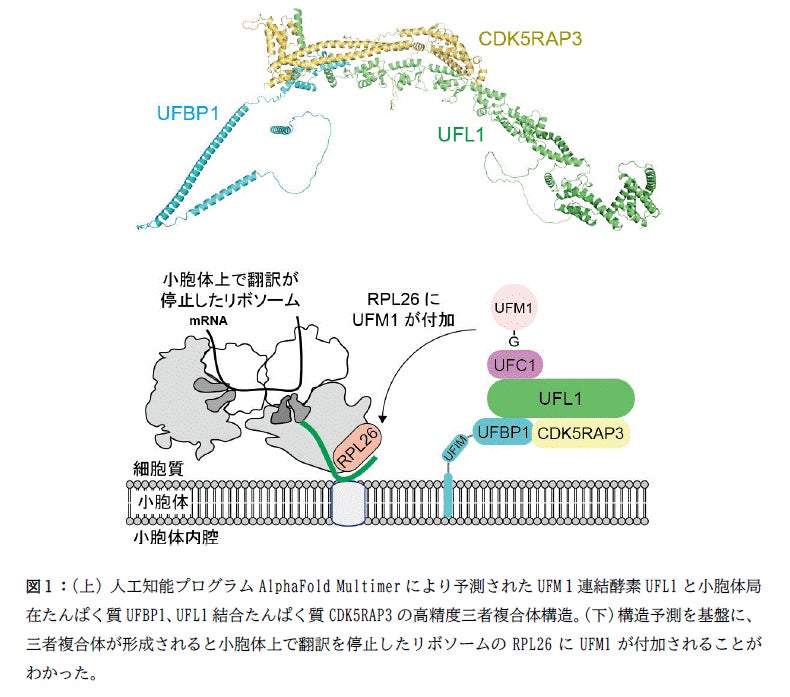
人工知能プログラムにより高精度なUFM1 連結酵素複合体の構造予測に成功した。
UFM1 連結酵素の三者複合体形成がRPL26へのUFM1連結に必要であった。
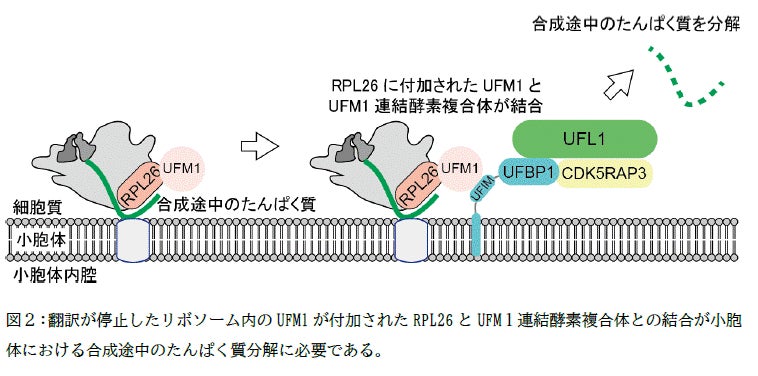
UFM1 連結酵素複合体とUFM1が連結されたRPL26との結合がER-RQCに必要であった。
背景
研究グループは、ヒトゲノムデータベースと質量分析解析によりたんぱく質修飾システムUFM1システム(*5)を発見し、このシステムを構成するたんぱく質を作り出す遺伝子の変異が遺伝性の発達・てんかん性脳症を引き起こすことを報告してきました。
UFM1システムとは、UFM1をUFM1活性化酵素、UFM1結合酵素、そしてUFM1 連結酵素を介して細胞内たんぱく質に共有結合するシステムであり、UFM1 連結酵素が基質特異性(細胞内のどのたんぱく質に結合するのか)を決定することが知られています。しかしながら、UFM1 連結酵素の立体構造が解かれておらず、その詳細な仕組みは不明でした。
内容
今回、研究グループは人工知能プログラムAlphaFold Multimerを用いてUFM1 連結酵素複合体の構造予測を行いました。その結果、UFM1 連結酵素であるUFL1と小胞体に局在するUFBP1とが安定に複合体を形成すること、その複合体にCDK5RAP3が結合すると小胞体上で翻訳が停止したリボソーム(*6)のRPL26にUFM1が連結されることが明らかになりました(図1)。さらに、このUFM1 連結酵素複合体は、UFBP1に含まれるUFM1結合モチーフを介してUFM1が連結されたRPL26に結合すること、このUFIMを介した結合が小胞体における合成途中のたんぱく質分解に必要であることが明らかになりました(図2)。
今後の展開
今回の成果は、基礎研究における人工知能の有用性を示すとともに、細胞のたんぱく質品質管理機構に新たな知見を与えるものです。さらに、UFM1システムの異常が直接に関与する遺伝性の発達・てんかん性脳症発症の発症機構の解明にも繋がるものです。
用語解説
*1 人工知能プログラムAlphaFold Multimer :2020年11月30日にDeepMind社が発表した人工知能プログラムAlphaFold2は、わずかな時間でアミノ酸配列からその立体構造を極めて高い精度で予測できることを示し、生命科学全般の研究に大きな影響を与えました。2022年3月にはたんぱく質−たんぱく質複合体を予測するために構築されたAlphaFold Multimer(バージョン2.2.0)が公開され、複数のアミノ酸配列を入力するだけで複数のたんぱく質からなる複合体の予測構造を出力させることができることが示されました。
*2 UFM1 連結酵素:UFL1(UFM1-ligating enzyme 1)と呼ばれ、UFM1のシステムにおいて基質選択性を担保します。
*3 小胞体における合成途中のたんぱく質品質管理機構(ER-RQC):翻訳伸長反応の正確かつ厳密な制御は、正確な遺伝子発現にきわめて重要です。たんぱく質の合成途上での翻訳停止は遺伝子産物の機能に重大な欠損を示すため、翻訳停止した合成途中のたんぱく質は複数の品質管理機構によって認識され排除されます。翻訳伸長の反応が途中で停止した場合、合成途上のポリペプチド鎖はユビキチン化とプロテアソームによる迅速な分解を受けますが、それをribosome-associated quality control(RQC)と呼びます。膜たんぱく質や分泌たんぱく質は小胞体(ER)上でのリボソームで翻訳され、小胞体内腔に運ばれる必要があります。膜たんぱく質や分泌たんぱく質のRQCはER-RQCと呼ばれます。
*4 UFM1システムの異常による発達・てんかん性脳症:UFM1、UBA5、UFC1をコードする遺伝子変異により引き起こされる遺伝性小児てんかん性脳症。病態発症機序は不明であり、アンメット・メディカル・ニーズの高い疾患。
*5 UFM1システム: UFM1をUFM1活性化酵素、UFM1結合酵素、そしてUFM1 連結酵素を介して細胞内たんぱく質に共有結合するシステム。UFM1 連結酵素が共有結合される細胞内たんぱく質を決定します。ER-phagyと呼ばれるオートファジーによる選択的な小胞体分解やER-RQCを制御すると考えられています。
*6 リボソーム:リボソームタンパク質とリボソームRNA(rRNA)から構成される巨大な複合体であり、mRNAにコードされている遺伝暗号(コドン)に従ってアミノ酸同士を結合させ、たんぱく質を合成する装置。
原著論文
本研究はScience Advances誌のオンライン版に2023年8月18日付で公開されました。
タイトル:Mechanistic insights into the roles of the UFM1 E3 ligase complex in ufmylation and ribosome-associated protein quality control
タイトル(日本語訳):UFM1化と翻訳品質管理機構におけるUFM1 E3複合体の役割
著者:Ryosuke Ishimura1, #, Sota Ito2, #, Gaoxin Mao1, Satoko Komatsu-Hirota1, Toshifumi Inada2,*, Nobuo N Noda3,* and Masaaki Komatsu1,* (#co-first authors, *co-corresponding authors)
著者(日本語表記):石村亮輔1, #, 伊藤壮太2, #, 毛高鑫1, 小松-廣田聡子1, 稲田利文2,*, 野田展生3,*, 小松雅明1,* (#共同筆頭著者, *共同責任著者)
著者所属:1) 順天堂大学大学院医学研究科器官・細胞生理学、2) 東京大学医科学研究所RNA制御学分野、3)北海道大学遺伝子病制御研究所生命分子機構分野
DOI: 10.1126/sciadv.adh.3635
本研究はJSPS科研費(JP22K06931, JP21H04163, JP19H05281, JP21H05277, JP22H00401, JP19H05707, JP19H05706, JP21H004771)、革新的先端研究開発支援事業AMED-CREST(JP20gm1110010, JP22gm1410004)、戦略的創造研究推進事業JST-CREST(JPMJCR20E3)、武田科学振興財団などの支援を受け実施されました。本研究にご協力いただいた皆様には深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
